
Justification, préparation et utilisation de la gélose TCBS
le Gélose TCBS est un milieu de culture solide très sélectif et différentiel, utilisé pour l'isolement et la culture de bactéries du genre Vibrio, en particulier Vibrio cholerae, V. vulnificus Oui V. parahaemolyticus comme principaux agents pathogènes de ce genre.
L'acronyme TCBS signifie Thiosulfate Citrate Bile Sucrose. Cette gélose est également connue comme milieu sélectif pour les Vibrios. La formule originale a été créée par Nakanishi et modifiée plus tard par Kobayashi.

Il est composé d'extrait de levure, de peptone de viande, de triptein, de citrate de sodium, de thiosulfate de sodium, de bile de bœuf, de saccharose, de chlorure de sodium, de citrate ferrique, de bleu de bromothymol, de bleu de thymol et d'agar..
Cette composition permet un développement adéquat des espèces de Vibrio à partir d'échantillons d'eau, de nourriture et de matières fécales; A l'exception de Vibrio hollisae, qui ne pousse pas dans cet environnement. De plus, le milieu TCBS est capable d'inhiber la croissance d'autres bactéries accompagnantes, en particulier les coliformes..
En raison des graves problèmes gastro-intestinaux et extra-intestinaux que certaines espèces du genre Vibrio produisent, son diagnostic est très important. Les humains sont principalement infectés en consommant des aliments crus ou mal cuits de la mer ou des eaux polluées, mais aussi par l'infection des plaies.
Pour cette raison, les laboratoires cliniques doivent inclure la gélose TCBS dans l'étude de culture de selles d'échantillons de selles liquides, en particulier avec l'apparition d'eau de riz. Surtout si le patient déclare avoir été en contact avec de l'eau de mer ou avoir consommé des crustacés ou du poisson.
Index des articles
- 1 Justification
- 2 Préparation
- 3 Utilisation
- 4 semé
- 5 Limitation
- 6 Contrôle de la qualité
- 7 Références
Base
L'extrait de levure, les peptones de viande et la triptein sont la source nutritionnelle de ce milieu. Cependant, la gélose TCBS est un milieu inhospitalier pour la plupart des bactéries..
Sa haute sélectivité est donnée par l'addition de citrate de sodium et de bile de bœuf; tous deux sont des agents inhibiteurs qui fournissent également un pH alcalin au milieu, limitant la croissance de la flore qui l'accompagne et favorisant la croissance de V. cholerae, entre autres espèces. Notamment Vibrio cholerae est très sensible à l'acidité.
De son côté, le chlorure de sodium équilibre osmotiquement le milieu. De plus, sa concentration étant élevée, il agit également comme un agent inhibiteur, favorisant la croissance des bactéries halophiles..
Le saccharose est le sucre fermentescible qui, associé aux indicateurs de pH bleu bromothymol et bleu thymol, confère au milieu son caractère différentiel. Pour cette raison, avec ce milieu, il est possible de différencier les souches fermentant le saccharose des souches non fermentantes..
Les colonies de souches fermentant le saccharose développent une couleur jaune et font passer le milieu du vert au jaune par production d'acide. Les non-fermenteurs deviennent translucides et le milieu reste la couleur d'origine (vert).
De même, ce milieu contient du thiosulfate de sodium comme source de soufre et du citrate ferrique comme révélateur. Les deux présentent des bactéries capables de produire du sulfure d'hydrogène (gaz incolore). Le HdeuxS est formé à partir de thiosulfate et par la suite, lors de la réaction avec le citrate ferrique, un précipité noir visible se forme..
Enfin, la gélose est celle qui donne la consistance solide au milieu.
préparation
Peser 89 g de milieu déshydraté et dissoudre dans un litre d'eau distillée. Aide à la dissolution en chauffant et en remuant fréquemment. Le mélange peut être bouilli jusqu'à 2 minutes..
Ce milieu n'est pas autoclavé. Après dissolution, il est servi directement sur des assiettes stériles. Lorsqu'elles se solidifient, elles sont disposées de manière inversée en plaquettes et conservées au réfrigérateur (2-8 ° C) jusqu'à utilisation..
Le milieu après préparation doit rester à pH 8,6 ± 0,2.
La couleur du support déshydraté est beige clair ou beige verdâtre, et la couleur du support est vert forêt ou vert bleuâtre.
Il est important de laisser les plaques se réchauffer avant de semer les échantillons..
Utiliser
Le spécimen le plus courant pour l'isolement de Vibrios est les selles diarrhéiques..
Les échantillons de selles s'ils ne peuvent pas être immédiatement ensemencés sur le milieu sélectif, ils doivent être transportés sur le milieu Cary Blair..
Pour augmenter la sensibilité de la culture, les matières fécales peuvent être passées à travers de l'eau peptonée à pH 8,4 comme milieu d'enrichissement pendant un maximum de 8 heures, à partir de là, elles sont repiquées dans le milieu TCBS..
Il faut également tenir compte du fait que certaines souches de Vibrios peuvent provoquer une septicémie chez les patients immunodéprimés, elles peuvent donc être isolées à partir d'hémocultures. De même, des échantillons d'eau et de nourriture de la mer peuvent être analysés en cas d'épidémie de choléra..
Semé
L'inoculum de l'échantillon étudié doit être proéminent, le semis est réalisé par la méthode de striation par épuisement. Les plaques sont incubées à 37 ° C pendant 24 heures en aérobiose.
Les colonies présomptives de Vibrio cholerae ils sont de taille moyenne, lisses, opaques, à bords fins et de couleur jaune en raison de la fermentation du saccharose.
De même, les espèces de V. alginolyticus, V. fluvialis, V. hareyi, V. cincinnatiensis, V. Furnissii, V. metschnikovii et certaines V. vulnificus. D'autres espèces de Vibrios cliniquement importantes telles que V. parahaemolyticus ne pas fermenter le saccharose, se développant en colonies vert olive.
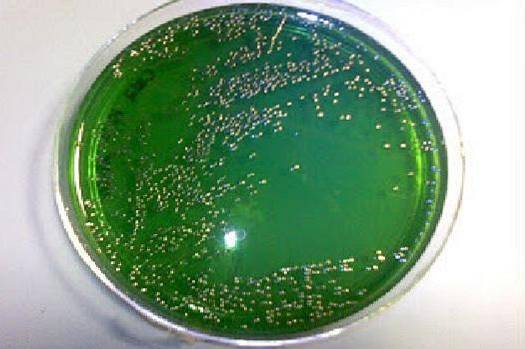
D'autre part, il faut garder à l'esprit que certaines souches d'Aeromonas et de Plesiomonas qui sont oxydase (+) peuvent se développer dans ce milieu, développant des colonies jaunes qui peuvent dérouter le clinicien. Alors que certaines souches de Pseudomonas également oxydase (+) se développent comme des colonies vertes, tout comme V. parahaemolyticus.
Limitation
Le test d'oxydase qui est positif pour le genre Vibrio ne doit jamais être effectué à partir de colonies obtenues à partir de gélose TCBS, car le résultat obtenu sera un faux négatif. Les composés au milieu interfèrent fortement avec ce test. Par conséquent, il doit être effectué à partir de sous-cultures sur gélose au sang..
Contrôle de qualité
Pour prouver que le milieu est en bon état, il est conseillé de semer des souches témoins connues ou certifiées, et d'observer si la croissance répond aux caractéristiques attendues..
Pour cela, vous pouvez utiliser des souches de:
-Vibrio cholerae - croissance satisfaisante (colonies jaunes, bordure translucide).
-Vibrio parahaemolyticus - croissance satisfaisante (colonie avec centre vert et bordure translucide).
-Vibrio alginolyticus ATCC 17749 - croissance satisfaisante (colonies jaunes avec halos de même couleur autour de la colonie).
-Enterococcus faecalis ATCC 29212 - inhibition totale ou partielle (petites colonies jaunes ou translucides).
-Pseudomonas aeruginosa ATCC 27853 - inhibition partielle ou totale (colonies bleues).
-Escherichia coli ATCC 25922 - Complètement inhibé.
-Proteus mirabilis ATCC 43071 - Inhibition totale ou partielle. (Petites colonies centre vert bord translucide).
L'incubation du milieu non ensemencé doit être inchangée.
Les références
- Laboratoires Difco Francisco Soria Melguizo. Gélose TCBS. 2009. Disponible sur: f-soria.es
- Laboratoire BD. BD. TCBS Agar 2003. Disponible sur: bd.com
- Laboratoires Britannia. TCBS Medium. 2015. Disponible sur: britanialab.com
- Laboratoires Acumedia. Gélose TCBS. 2016. Disponible sur: foodsafety.neogen.com
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnostic microbiologique Bailey & Scott. 12 éd. Éditorial Panamericana S.A. Argentine.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnostic microbiologique. 5e éd. Éditorial Panamericana S.A. Argentine.



Personne n'a encore commenté ce post.