
Comment calculer l'absorbance molaire et les exercices résolus
La absorptivité molaire c'est une propriété chimique qui indique la quantité de lumière qu'une espèce peut absorber en solution. Ce concept est très important dans l'analyse spectroscopique de l'absorption du rayonnement photonique avec des énergies dans le domaine ultraviolet et visible (UV-vis)..
Comme la lumière est composée de photons avec ses propres énergies (ou longueurs d'onde), selon l'espèce ou le mélange analysé, un photon peut être absorbé à un plus grand degré qu'un autre; c'est-à-dire que la lumière est absorbée à certaines longueurs d'onde caractéristiques de la substance.

Ainsi, la valeur de l'absorbance molaire est directement proportionnelle au degré d'absorption de la lumière à une longueur d'onde donnée. Si l'espèce absorbe peu de lumière rouge, sa valeur d'absorption sera faible; alors que s'il y a une absorption prononcée de la lumière rouge, l'absorptivité aura une valeur élevée.
Une espèce qui absorbe la lumière rouge reflétera une couleur verte. Si la couleur verte est très intense et sombre, cela signifie qu'il y a une forte absorption de la lumière rouge.
Cependant, certaines nuances de vert peuvent être dues aux reflets de différentes gammes de jaunes et de bleus, qui sont mélangés et perçus comme turquoise, émeraude, verre, etc..
Index des articles
- 1 Qu'est-ce que l'absorbance molaire?
- 1.1 Unités
- 2 Comment le calculer?
- 2.1 Dédouanement direct
- 2.2 Méthode graphique
- 3 exercices résolus
- 3.1 Exercice 1
- 3.2 Exercice 2
- 4 Références
Quelle est l'absorbance molaire?
L'absorbance molaire est également connue sous les désignations suivantes: extinction spécifique, coefficient d'atténuation molaire, absorption spécifique ou coefficient de Bunsen; Il a même fini par être nommé d'une autre manière, donc cela a été une source de confusion.
Mais qu'est-ce que l'absorbance molaire exactement? C'est une constante qui est définie dans l'expression mathématique de la loi de Lamber-Beer, et elle indique simplement combien l'espèce chimique ou le mélange absorbe la lumière. Une telle équation est:
A = εbc
Où A est l'absorbance de la solution à une longueur d'onde choisie λ; b est la longueur de la cellule où se trouve l'échantillon à analyser, et par conséquent, est la distance que la lumière traverse à l'intérieur de la solution; c est la concentration de l'espèce absorbante; et ε, l'absorbance molaire.
Étant donné λ, exprimé en nanomètres, la valeur de ε reste constante; mais lors du changement des valeurs de λ, c'est-à-dire lors de la mesure des absorbances avec des lumières d'autres énergies, ε change, atteignant une valeur minimale ou maximale.
Si sa valeur maximale est connue, εmax, est déterminé en même temps λmax; c'est-à-dire la lumière que l'espèce absorbe le plus:
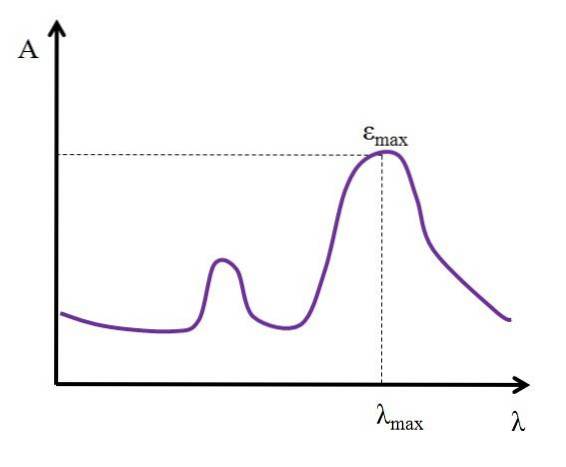
Unités
Quelles sont les unités de ε? Pour les trouver, il faut savoir que les absorbances sont des valeurs sans dimension; et par conséquent, la multiplication des unités de b et c doit annuler.
La concentration de l'espèce absorbante peut être exprimée soit en g / L soit en mol / L, et b est généralement exprimée en cm ou en m (car c'est la longueur de la cellule que traverse le faisceau lumineux). La molarité est égale à mol / L, donc c est également exprimé en M.
Ainsi, en multipliant les unités de b et c, on obtient: M ∙ cm. Quelles unités doivent alors ε pour que la valeur de A soit sans dimension? Celles qui multiplient M ∙ cm donnent une valeur de 1 (M ∙ cm x U = 1). En résolvant pour U, nous obtenons simplement M-1∙ cm-1, qui peut aussi s'écrire: L ∙ mol-1∙ cm-1.
En fait, utilisez les unités M-1∙ cm-1 ou L ∙ mol-1∙ cm-1 accélérer les calculs pour déterminer l'absorbance molaire. Cependant, il est aussi souvent exprimé en unités de mdeux/ mol ou cmdeux/ mol.
Lorsqu'ils sont exprimés avec ces unités, certains facteurs de conversion doivent être utilisés pour modifier les unités de b et c.
Comment le calculer?
Dédouanement direct
L'absorbance molaire peut être calculée directement en la résolvant dans l'équation ci-dessus:
ε = A / bc
Si la concentration de l'espèce absorbante, la longueur de cellule et l'absorbance obtenue à une longueur d'onde sont connues, ε peut être calculé. Cependant, cette façon de le calculer renvoie une valeur inexacte et peu fiable.
Méthode graphique
Si vous regardez de près l'équation de la loi de Lambert-Beer, vous remarquerez qu'elle ressemble à l'équation d'une droite (Y = aX + b). Cela signifie que si les valeurs de A sont tracées sur l'axe Y, et celles de c sur l'axe X, il faut obtenir une droite passant par l'origine (0,0). Ainsi, A deviendrait Y, X serait c et a serait égal à εb.
Par conséquent, une fois la ligne tracée, il suffit de prendre deux points quelconques pour déterminer la pente, c'est-à-dire a. Une fois que cela est fait et que la longueur de la cellule, b, est connue, il est facile de résoudre la valeur de ε.
Contrairement au jeu direct, la représentation graphique de A vs c permet de faire la moyenne des mesures d'absorbance et de réduire l'erreur expérimentale; et de plus, des lignes infinies peuvent passer par un seul point, donc le dégagement direct n'est pas pratique.
De même, des erreurs expérimentales peuvent empêcher une ligne de passer par deux, trois points ou plus, de sorte que la ligne obtenue après l'application de la méthode des moindres carrés est effectivement utilisée (une fonction qui est déjà incorporée dans les calculatrices). Tout cela dans l'hypothèse d'une linéarité élevée, et donc du respect de la loi Lamber-Beer..
Exercices résolus
Exercice 1
On sait qu'une solution d'un composé organique de concentration 0,008739 M présentait une absorbance de 0,6346, mesurée à λ = 500 nm et avec une longueur de cellule de 0,5 cm. Calculer l'absorbance molaire du complexe à cette longueur d'onde.
A partir de ces données, ε peut être résolu directement:
ε = 0,6346 / (0,5 cm) (0,008739 M)
145,23 M-1∙ cm-1
Exercice 2
Les absorbances suivantes sont mesurées à différentes concentrations d'un complexe métallique à une longueur d'onde de 460 nm et avec une cellule de 1 cm de longueur:
A: 0,03010 0,1033 0,1584 0,3961 0,8093
c: 1,8 ∙ 10-5 6 ∙ 10-5 9,2 ∙ 10-5 2,3 ∙ 10-4 5,6 ∙ 10-4
Calculer l'absorbance molaire du complexe.
Il y a un total de cinq points. Pour calculer ε, il est nécessaire de les représenter graphiquement en plaçant les valeurs de A sur l'axe Y, et les concentrations c sur l'axe X. Une fois cela fait, la ligne des moindres carrés est déterminée, et avec son équation nous pouvons déterminer ε.
Dans ce cas, tracer les points et tracer la ligne avec un coefficient de détermination Rdeux 0,9905, la pente est égale à 7 ∙ 10-4; c'est-à-dire εb = 7 ∙ 10-4. Donc, avec b = 1cm, ε sera 1428,57 M-1.cm-1 (1/7 ∙ 10-4).
Les références
- Wikipédia. (2018). Coefficient d'atténuation molaire. Récupéré de: en.wikipedia.org
- Science frappée. (2018). Absorptivité molaire. Récupéré de: sciencestruck.com
- Analyse colorimétrique: (loi de Beer ou analyse spectrophotométrique). Récupéré de: chem.ucla.edu
- Kerner N. (s.f.). Expérience II - Couleur de la solution, absorbance et loi de bière. Récupéré de: umich.edu
- Day, R., et Underwood, A. Chimie analytique quantitative (cinquième éd.). Salle des Prentices PEARSON, p-472.
- Gonzáles M. (17 novembre 2010). Absorptivité Récupéré de: quimica.laguia2000.com



Personne n'a encore commenté ce post.