
Structure en acétate d'aluminium (Al (CH3COO) 3), propriétés, utilisations

le acétate d'aluminium est un composé organique formé par un ion aluminium Al3+ et trois ions acétate CH3ROUCOULER-. Sa formule chimique est Al (CH3ROUCOULER)3. Il est également connu sous le nom de triacétate d'aluminium. C'est un solide blanc légèrement hygroscopique et soluble dans l'eau..
Pour obtenir ce composé, il faut utiliser des conditions totalement anhydres, c'est-à-dire exemptes d'eau, sinon le diacétate d'aluminium Al (OH) (CH3ROUCOULER)deux.
Les solutions d'acétate d'aluminium ont des propriétés antibactériennes et antifongiques, c'est pourquoi, depuis le 19ème siècle, elles sont utilisées pour traiter les infections en particulier des oreilles..
La plus connue est la solution de Burow, conçue par un médecin allemand. Cependant, son utilisation a parfois entraîné des lésions de l'oreille moyenne..
Cette solution a également été utilisée pour traiter les problèmes de peau tels que les démangeaisons et les éruptions cutanées. Il est même utilisé comme anti-coup de soleil.
L'acétate d'aluminium et ses dérivés sont utilisés pour obtenir de très petites structures ou particules d'alumine AldeuxOU ALORS3. Ces structures ou nanoparticules peuvent se présenter sous forme de feuilles, de fleurs ou de nanotubes..
Index des articles
- 1 Structure
- 2 Nomenclature
- 3 propriétés
- 3.1 État physique
- 3.2 Poids moléculaire
- 3.3 Solubilité
- 3.4 Propriétés chimiques
- 3.5 Autres propriétés
- 4 Obtention
- 5 utilisations en médecine
- 5.1 Infections de l'oreille
- 5.2 Maladies de la peau
- 6 Autres utilisations
- 6.1 Utilisation interrompue
- 7 Effets nocifs
- 8 Références
Structure
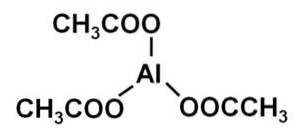
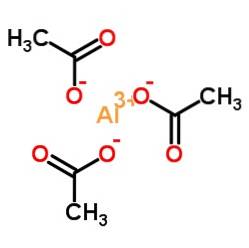
Le triacétate d'aluminium est composé d'un cation aluminium Al3+ et trois anions acétate CH3ROUCOULER-. C'est le sel d'aluminium de l'acide acétique CH3COOH.
L'aluminium est lié aux anions acétates par leur oxygène. En d'autres termes, il est attaché à trois oxygènes. Ces jonctions sont ioniques.
Nomenclature
- Acétate d'aluminium
- Triacétate d'aluminium
- Éthanoate d'aluminium
- Burow's solution (traduction de l'anglais La solution de Burow): C'est une solution d'acétate d'aluminium.
Propriétés
État physique
Blanc uni.
Poids moléculaire
204,11 g / mol
Solubilité
Soluble dans l'eau.
Propriétés chimiques
En solution aqueuse, le triacétate d'aluminium est dissous et a tendance à former du diacétate Al (OH) (CH3COO) et parfois monoacétate d'Al (OH)deux(CH3ROUCOULER). Tout dépend du pH et de la quantité d'acide acétique CH3COOH présent dans la solution.
Al (CH3ROUCOULER)3 + HdeuxO ⇔ Al (OH) (CH3ROUCOULER)deux + CH3COOH
Al (CH3ROUCOULER)3 + 2 heuresdeuxO ⇔ Al (OH)deux(CH3COO) + 2 CH3COOH
Autres propriétés
L'acétate d'aluminium est légèrement hygroscopique, c'est-à-dire qu'il a tendance à absorber l'eau de l'air.
Obtention
L'acétate d'aluminium est de préférence obtenu dans des conditions strictement anhydres, c'est-à-dire en l'absence totale d'eau. Cela inclut également l'absence d'air, car il peut contenir de l'humidité..
Chauffer un mélange d'acide acétique glacial CH3COOH et anhydride acétique (CH3CO)deuxOu dans des conditions telles que toute l'eau présente peut être éliminée. Du chlorure d'aluminium AlCl est ajouté à ce mélange chaud.3 solide anhydre (sans eau).
Un solide blanc d'Al (CH3ROUCOULER)3.
AlCl3 + 3 CH3COOH → Al (CH3ROUCOULER)3 + 3 HCl
L'absence totale d'eau est importante pour éviter la formation de sels de monoacétate d'aluminium Al (OH)deux(CH3COO) et diacétate d'aluminium Al (OH) (CH3ROUCOULER)deux.
Il peut également être obtenu par réaction d'hydroxyde d'aluminium Al (OH)3 et acide acétique CH3COOH.
Utilisations en médecine
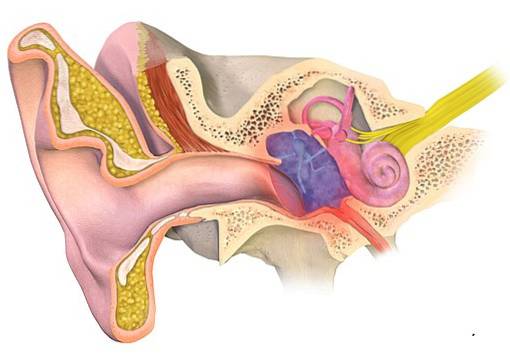
Infections de l'oreille
L'acétate d'aluminium est utilisé depuis le 19ème siècle pour traiter l'otite, qui est une inflammation de l'oreille externe ou moyenne généralement accompagnée d'une infection. Son utilisation est due à son effet antibactérien et antifongique.
Il a été utilisé sous la forme d'une solution d'acétate d'aluminium à 13%, conçue à l'origine par le médecin allemand Karl August von Burow, c'est pourquoi on l'appelle la solution de Burow..
Il a été trouvé qu'il inhibe la croissance des micro-organismes que l'on trouve couramment dans l'otite moyenne ou externe, comme l'otite moyenne. Pseudomonas aeruginosa, les Staphylococcus aureus et le Proteus mirabilis.

Cependant, certains rapportent que ces solutions peuvent être nocives pour l'oreille. Certaines études animales examinent ses effets toxiques sur l'oreille, mais ont rapporté des résultats contradictoires..
Certains chercheurs recommandent de ne pas utiliser d'acétate d'aluminium lorsque la membrane tympanique est perforée, car il a été observé qu'il exerce un effet inflammatoire sur l'oreille moyenne.
Maladies de la peau
La solution de Burow est utilisée comme antiseptique, astringent et comme solution topique pour traiter les éruptions cutanées sévères, la dermatite, l'inflammation, les démangeaisons, les brûlures et les coups de soleil. A un effet calmant et anti-irritant.
Autres utilisations
Le triacétate d'aluminium et ses dérivés sont utilisés pour de nombreuses expériences chimiques qualitatives et quantitatives.
Un dérivé du triacétate d'aluminium, Al (OH) (CH3ROUCOULER)deux également appelé acétate d'hydroxyde d'aluminium, il est utilisé comme précurseur pour obtenir des nanostructures de gamma-alumine (γ-AldeuxOU ALORS3).
Dans ce cas, précurseur signifie que les nanostructures γ-Al sont préparées à partir de diacétate d'aluminium (obtenu de manière particulière).deuxOU ALORS3, et ceci est réalisé en le chauffant à des températures très élevées.
Les nanostructures sont de très petites particules qui ne peuvent être observées qu'à travers des microscopes spéciaux tels que les microscopes électroniques. Avec l'acétate d'aluminium comme précurseur, des nanostructures γ-Al ont été obtenuesdeuxOU ALORS3 semblable aux feuilles, aux fleurs, aux fibres et même aux nanotubes.

Utilisation interrompue
Au début du 20e siècle, l'acétate d'aluminium était utilisé comme agent de conservation dans des aliments tels que les saucisses en conserve.
Une solution d'acétate d'aluminium a été préparée en mélangeant du sulfate d'aluminium Aldeux(SW4)3, carbonate de calcium CaCO3, acide acétique CH3COOH et eau HdeuxOu, et il a été ajouté à la nourriture.
Lorsque cette solution entre en contact avec la viande, l'aluminium se fixe dans ses constituants sous forme d'un composé insoluble dans l'eau bouillante, mais qui se dissout dans les sucs gastriques à environ 80%.
Dès 1904, on savait que les sels d'aluminium ralentissaient la digestion, à la fois dans l'estomac et dans les intestins. Par conséquent, il n'est pas souhaitable d'ajouter des solutions d'acétate d'aluminium aux aliments en conserve..

Effets dommageables
Puisqu'il existe des études qui rapportent que l'acétate d'aluminium peut être toxique, des tests ont été effectués dans lesquels des souris de laboratoire ont été injectées avec de l'acétate d'aluminium.
Les résultats indiquent que ce composé cause des dommages à la colonne vertébrale desdits animaux, ainsi que des dommages aux chromosomes et au sperme des animaux. En d'autres termes, il est génotoxique.
Cela vous avertit des risques potentiels pour la santé qui pourraient être causés par une surexposition à l'acétate d'aluminium et des précautions à prendre lors de son utilisation..
Les références
- Mac-Kay Chace, E. (1904). L'utilisation d'acétate d'aluminium basique comme conservateur dans la saucisse. Journal de l'American Chemical Society 1904, 26, 6: 662-665. Récupéré de pubs.acs.org.
- Hood, G.C. et Ihde, A.J. (1950). Acétates et propionates d'aluminium - leur préparation et leur composition. Journal de l'American Chemical Society 1950, 72, 5: 2094-2095. Récupéré de pubs.acs.org.
- Pitaro, J. et coll. (2013). Ototoxicité de la solution otique d'acétate d'aluminium / chlorure de benzèneéthonium dans le modèle animal Chinchilla. Laryngoscope, 2013; 123 (10): 2521-5. Récupéré de ncbi.nlm.nih.gov.
- Thorp, M.A. et coll. (2000). Solution de Burow dans le traitement de l'otite moyenne suppurée chronique muqueuse active: déterminer une dilution efficace. The Journal of Laryngology & Otology, juin 2000, vol. 114, pp. 432-436. Récupéré de ncbi.nlm.nih.gov.
- D'Souza, M. P. et coll. (2014). Évaluation de la génotoxicité de l'acétate d'aluminium dans la moelle osseuse, les cellules germinales mâles et les cellules hépatiques fœtales de souris albinos suisses. Mutation Research 766 (2014) 16-22. Récupéré de ncbi.nlm.nih.gov.
- Basal, Y. et al. (2015). Les effets des solutions topiques de Burow et Castellani sur la muqueuse de l'oreille moyenne des rats. J. Int Adv Otol 2015; 11 (3): 253-6. Récupéré de advancedotology.org.
- NOUS. Bibliothèque nationale de médecine. (2019). Acétate d'aluminium. Récupéré de pubchem.ncbi.nlm.nih.gov.
- Buttaravoli, P. et Leffler, S.M. (2012). Coup de soleil. Que faire. Dans les urgences mineures (troisième édition). Récupéré de sciencedirect.com.
- Thompson, E. et Kalus, A. (2017). Réactions cutanées aiguës et infections bactériennes. Traitement. Dans The Travel and Tropical Medicine Manual (cinquième édition). Récupéré de sciencedirect.com.
- Kim, T. et coll. (2010). Synthèse contrôlable par morphologie de nanostructures gamma-alumine via une voie hydrothermale ionique assistée par liquide. Crystal Growth & Design, vol. 10, n ° 7, 2010, pp. 2928-2933. Récupéré de pubs.acs.org.
- Rajala, J.W. et coll. (2015). Fibres céramiques creuses en oxyde d'aluminium Core-Shell Electrospun. Fibres 2015, 3, 450-462. Récupéré de mdpi.com.

Personne n'a encore commenté ce post.