
Structure, propriétés, utilisations de l'acétonitrile (C2H3N)
le acétonitrile C'est une substance d'origine organique composée uniquement de carbone, d'hydrogène et d'azote. Cette espèce chimique appartient au groupe des nitriles, l'acétonitrile étant celui qui a la structure la plus simple parmi ceux de type organique..
Les nitriles sont une classe de composés chimiques dont la structure est constituée d'un groupe cyanure (CN-) et une chaîne radicalaire (-R). Ces éléments sont représentés par la formule générale suivante: R-C≡N.
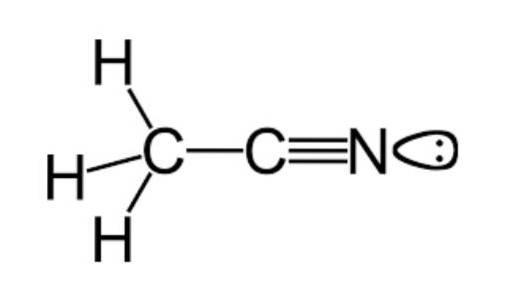
On sait que cette substance provient principalement de la production d'une autre espèce appelée acrylonitrile (un autre nitrile simple, de formule moléculaire C3H3N, qui est utilisé dans la fabrication de produits dans l'industrie textile) en tant que sous-produit du même.
De plus, l'acétonitrile est considéré comme un solvant aux propriétés de polarité moyenne, c'est pourquoi il est utilisé assez régulièrement dans les analyses RP-HPLC (chromatographie liquide à haute performance en phase inverse)..
Index des articles
- 1 Structure
- 2 propriétés
- 3 utilisations
- 4 risques
- 5 Références
Structure
Comme mentionné précédemment, l'acétonitrile appartient au groupe fonctionnel des nitriles, ayant une formule moléculaire communément représentée par CdeuxH3N, qui peut être vu dans la formule structurelle qui est illustrée dans la figure supérieure.
Cette image montre une sorte de lobe attaché à l'atome d'azote, qui représente la paire d'électrons non appariés que possède cet atome, et qui lui confèrent une grande partie des propriétés de réactivité et de stabilité qui en sont caractéristiques..
De cette manière, cette espèce présente un comportement très particulier en raison de sa disposition structurelle, qui se traduit par une faiblesse pour recevoir des liaisons hydrogène et une faible capacité à donner des électrons..
En outre, cette substance est née pour la première fois dans la seconde moitié des années 1840, étant fabriquée par le scientifique nommé Jean-Baptiste Dumas, dont la nationalité était française..
La conformation structurelle de cette substance lui permet d'avoir les caractéristiques de son propre solvant de nature organique..
A son tour, cette propriété permet de mélanger l'acétonitrile avec de l'eau, ainsi qu'une série d'autres solvants d'origine organique, à l'exception des hydrocarbures ou des espèces hydrocarbonées de type saturé..
Propriétés
Ce composé a une série de propriétés qui le distinguent des autres de sa même classe, qui sont énumérés ci-dessous:
- Il est à l'état liquide d'agrégation dans des conditions standard de pression et de température (1 atm et 25 ° C).
- Sa configuration moléculaire lui confère une masse molaire ou un poids moléculaire d'environ 41 g / mol.
- Il est considéré comme le nitrile qui a la structure la plus simple, parmi le type organique.
- Ses propriétés optiques lui permettent d'être incolore dans cette phase liquide et avec des caractéristiques limpides, en plus d'avoir une odeur aromatique..
- Il a un point d'éclair d'environ 2 ° C, ce qui équivaut à 35,6 ° F ou 275,1 K.
- Il a un point d'ébullition compris entre 81,3 et 82,1 ° C, une densité d'environ 0,786 g / cm3 et un point de fusion compris entre -46 et -44 ° C.
- Il est moins dense que l'eau mais miscible avec elle et avec une variété de solvants organiques.
- Il présente une constante diélectrique de 38,8 en plus d'un moment dipolaire d'environ 3,92 D.
- Il est capable de dissoudre une grande variété de substances d'origine ionique et de nature non polaire.
- Il est largement utilisé comme phase mobile dans l'analyse HPLC, qui possède des propriétés d'inflammabilité élevées.
Applications
Parmi le grand nombre d'applications de l'acétonitrile, on peut compter les suivantes:
- De même, d'autres espèces de nitriles peuvent subir un processus de métabolisation en microsomes (éléments vésiculaires faisant partie du foie), notamment dans cet organe, pour produire de l'acide cyanhydrique..
- Il est largement utilisé comme phase mobile dans le type d'analyse appelé chromatographie liquide haute performance en phase inverse (RP-HPLC); c'est-à-dire en tant que substance d'élution qui a une stabilité élevée, un grand pouvoir d'élution et une faible viscosité.
- Dans le cas d'applications d'ampleur industrielle, ce composé chimique est utilisé dans les raffineries de pétrole brut comme solvant dans certains procédés, comme la purification de l'alcène appelé butadiène..
- Il est également utilisé comme ligand (espèce chimique qui se combine avec un atome d'un élément métallique, considéré comme central dans la molécule donnée, pour former un composé ou complexe de coordination) dans un grand nombre de composés nitriles avec des métaux du groupe de transition.
- De même, il est utilisé en synthèse organique pour un grand nombre de produits chimiques avantageux tels que l'acide a-naphtalène acétique, la thiamine ou le chlorhydrate d'acétamidine..
Des risques
Les risques associés à l'exposition à l'acétonitrile sont divers. Parmi ceux-ci, il y a une diminution de la toxicité lorsque l'exposition est pour une période de temps réduite et en faibles quantités, métabolisée pour la production d'acide cyanhydrique..
De même, il y a rarement eu des cas enregistrés de personnes qui ont été empoisonnées par cette espèce chimique, empoisonnées par le cyanure présent dans la molécule après avoir été en contact avec l'acétonitrile à différents degrés (lorsqu'il est inhalé, ingéré ou absorbé par la peau).
Pour cette raison, les conséquences de sa toxicité sont retardées car le corps ne métabolise pas facilement cette substance en cyanure, puisqu'il faut deux à douze heures pour que cela se produise..
Cependant, l'acétonitrile est facilement absorbé par les poumons et le tractus gastro-intestinal. Par la suite, sa distribution se produit dans tout le corps, se produisant chez les humains et même chez les animaux et atteignant les reins et la rate..
D'autre part, outre les risques d'inflammabilité qu'il présente, l'acétonitrile est un précurseur de substances aussi toxiques que l'acide cyanhydrique ou le formaldéhyde. Son utilisation dans des produits appartenant au domaine cosmétique a même été interdite dans ce qu'on appelle l'Espace économique européen en 2000..
Les références
- Wikipédia. (s.f.). Acétonitrile. Récupéré de en.wikipedia.org
- PubChem. (s.f.). Acétonitrile. Récupéré de pubchem.ncbi.nlm.nih.gov
- Brown, P. R. (2000). Progrès de la chromatographie. Obtenu sur books.google.co.ve
- ScienceDirect. (s.f.). Acétonitrile. Récupéré de sciencedirect.com
- ChemSpider. (s.f.). Acétonitrile. Récupéré de chemspider.com



Personne n'a encore commenté ce post.