
Fondation, préparation et utilisation de la gélose Baird Parker
le Gélose Baird Parker C'est un milieu de culture solide, sélectif et différentiel. Il a été créé en 1962 pour la détection et le comptage des staphylocoques à coagulase positive (Staphylococcus aureus).
Il est composé d'hydrolysat de caséine pancréatique, d'extrait de viande, d'extrait de levure, de chlorure de lithium, de glycine, de pyruvate de sodium, de tellurite de potassium, d'agar et d'émulsion de jaune d'oeuf..
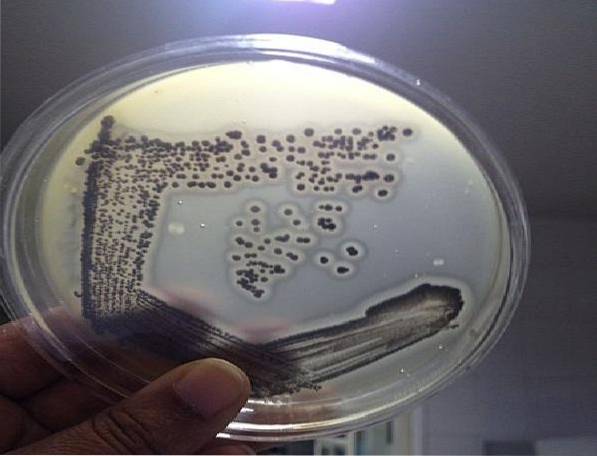
La gélose Baird Parker est basée sur la capacité du S. aureus pour réduire la tellurite et produire de la lécithinase. Les deux propriétés génèrent une colonie avec des caractéristiques spécifiques pour cette espèce. Par conséquent, il est très efficace pour détecter ce micro-organisme..
Les colonies typiques de S. aureus Ils sont noirs ou gris foncé, avec une bordure incolore et un léger halo qui les entoure, les différenciant des autres micro-organismes. Ce pathogène peut être trouvé dans les échantillons cliniques, les eaux, les cosmétiques et les aliments crus ou cuits..
Son diagnostic ou sa détection est de la plus haute importance, en raison de la variété des pathologies qu'il produit, telles que l'intoxication alimentaire, le syndrome de la peau échaudée, le syndrome de choc toxique, les abcès, la méningite, la septicémie, l'endocardite, entre autres..
Index des articles
- 1 Justification
- 1.1 Pouvoir nutritif
- 1.2 sélectif
- 1.3 Différentiel
- 2 Préparation
- 2.1 Émulsion de jaune d'oeuf
- 2.2 Tellurite de potassium 1% p / v
- 2.3 Préparation du milieu de culture
- 3 Utilisation
- 3.1 Échantillons cliniques
- 3.2 Échantillons d'aliments
- 3.3 Échantillons d'eau
- 4 Contrôle qualité
- 5 Recommandations
- 6 Références
Base
Pouvoir nourrissant
L'hydrolysat de caséine pancréatique, l'extrait de viande et l'extrait de levure sont les sources de nutriments, de vitamines et de minéraux nécessaires au développement microbien général, tandis que le pyruvate et la glycine sont des composés qui favorisent la croissance spécifique de Staphylococcus aureus.
Sélectif
La gélose Baird Parker est sélective car elle contient des substances qui inhibent la croissance de la flore qui l'accompagne, tout en favorisant le développement de S. aureus. Les composés inhibiteurs sont le chlorure de lithium et le tellurite de potassium..
Différentiel
Ce médium permet de différencier S. aureus du reste des staphylocoques à coagulase négative. S. aureus a la capacité de réduire la tellurite en tellure noir métallique libre, formant des colonies noires ou gris foncé.
De même, le jaune d'oeuf fournit les substrats pour démontrer la présence de l'enzyme lécithinase et de la lipase.. S. aureus est lécithinase positive et donc un halo clair sera observé autour de la colonie, indiquant que la lécithine a été hydrolysée.
En ce sens, l'apparition sur cette gélose de colonies noires brillantes ou gris foncé avec un léger halo autour d'elles indique la présence de S. aureus.
Si une zone de précipitation se forme, cela indique une activité lipase. Certaines souches de S. aureus ils sont lipase positifs et autres négatifs.
Dans le cas où le S. aureus Si la lipase est positive, une zone opaque sera observée autour de la colonie noire ou gris foncé, puis un léger halo dû à l'action de la lécithinase.
Colonies de bactéries autres que S. aureus capable de croître dans ce milieu développera des colonies incolores ou brunes, sans halo environnant.
Des colonies noires atypiques peuvent également être vues avec ou sans bordure incolore, mais sans halo léger. Ces colonies ne doivent pas être prises en compte, elles ne correspondent pas à S. aureus.
préparation
Émulsion de jaune d'oeuf
Prenez un œuf de poule frais, lavez-le bien et placez-le dans de l'alcool à 70% pendant 2 à 3 heures. L'œuf est ensuite ouvert de manière aseptique et le blanc est soigneusement séparé du jaune. Ensuite, 50 ml de jaune sont prélevés et mélangés à 50 ml de solution physiologique stérile..
Tellurite de potassium 1% p / v
Certaines maisons commerciales vendent du tellurite de potassium à 1% prêt à l'emploi. Il est ajouté au milieu avant que le milieu ne se solidifie.
Pour préparer cette solution en laboratoire, 1,0 g de tellurite de potassium est pesé et dissous dans une partie d'eau. Par la suite, la quantité d'eau est complète jusqu'à atteindre 100 ml. La solution doit être stérilisée par la méthode de filtration.
Préparation du milieu de culture
Peser 60 g du milieu déshydraté et dissoudre dans 940 ml d'eau distillée. Laisser reposer le mélange pendant environ 5 à 10 minutes.
Appliquez de la chaleur en remuant fréquemment le milieu pour améliorer le processus de dissolution. Portez à ébullition pendant une minute. Stériliser à l'autoclave à 121 ° C pendant 15 minutes.
Laisser reposer jusqu'à ce qu'il atteigne une température de 45 ° C et ajouter 50 ml de l'émulsion de jaune d'oeuf et 10 ml de tellurite à 1%. Bien mélanger et verser 15-20 ml sur des boîtes de Pétri stériles..
Laisser solidifier, disposer les pattes inversées et conserver au réfrigérateur jusqu'à utilisation.
Le pH final du milieu préparé doit être de 6,8 ± 0,2.
Avant de semer un échantillon, attendez que la plaque atteigne la température ambiante. Semez les plaques par stries ou semis en surface avec une spatule Drigalski.
La couleur du milieu déshydraté est beige clair et la couleur du milieu préparé est ambre clair.
Utiliser
Échantillons cliniques
Les échantillons cliniques sont semés directement en déchargeant une partie du matériau à une extrémité de la plaque, et de là, il est strié d'épuisement. Incuber pendant 24 à 48 heures à 35-37 ° C.
Échantillons alimentaires
Peser 10 g de l'échantillon alimentaire et homogénéiser dans 90 ml d'eau peptonée à 0,1%, à partir de là, des dilutions sont préparées si nécessaire. Inoculer les plaques en triple exemplaire avec 0,3 ml des solutions préparées et ensemencer en surface avec une spatule Drigalski. Incuber pendant 24 à 48 heures à 35-37 ° C.
Cette méthodologie permet de compter les colonies typiques obtenues et est idéale lorsque la présence de S. aureus au-dessus de 10 UFC par gr / ml d'échantillon.
Si le montant de S. aureus Il est petit ou il y a beaucoup de flore qui l'accompagne, il est suggéré d'enrichir l'échantillon en bouillon de soja trypticase avec 10% de NaCl et 1% de pyruvate de sodium. Cela favorisera la croissance de S. aureus et inhibera le développement de la flore qui l'accompagne. Les tubes turbides sont ensemencés sur de la gélose Baird Parker..
Échantillons d'eau
Dans un système de filtration sous vide stérilisé, 100 ml d'eau d'étude sont filtrés, puis la membrane microporeuse de 0,4 micron est retirée avec une pince stérile et placée sur une plaque Baird Parker. Incuber pendant 24 à 48 heures à 35-37 ° C. Cette technique permet de compter les colonies typiques de S. aureus.
Contrôle de qualité
Des souches connues peuvent être utilisées pour évaluer la qualité de la gélose Baird Parker, telles que Staphylococcus aureus ATCC 25923, Staphylococcus aureus ATCC 6538, Staphylococcus epidermidis ATCC 12228, Escherichia coli ATCC 25922 ou Proteus mirabilis ATCC 43071.
Dans le cas de souches de S. aureus L'ATCC est connu pour réduire la tellurite, et ils sont positifs pour les lipases et les lécithinases. Par conséquent, il doit y avoir un développement satisfaisant et développer des colonies convexes avec un centre noir et une bordure incolore, avec un halo opaque et un léger halo le plus à l'extérieur..
Pour sa part, S. epidermidis on s'attend à un développement médiocre sur ce milieu, avec des colonies gris brunâtre à noires, sans halo léger.
Afin de E. coli Oui P. mirabilis on s'attend à ce qu'elle soit totalement ou partiellement inhibée. En cas de croissance, des colonies brunes se développeront sans zone opaque, ni halo léger.
recommandations
-Le milieu ne doit pas être chauffé après avoir ajouté la tellurite et le jaune d'oeuf.
-La préparation de l'émulsion de jaune d'oeuf et son ajout au milieu est une étape très vulnérable à la contamination. Il faut prendre soin.
-S'il existe des colonies typiques de S. aureus doit être corroboré par le montage d'un test de coagulase sur ladite souche.
-S'il y a des résultats douteux avec la coagulase, d'autres tests de confirmation doivent être montés.
-Veillez à ne pas confondre la présence de colonies typiques de S. aureus avec colonies noires atypiques.
Les références
- Contributeurs Wikipedia. Gélose Baird-Parker. Wikipedia, l'encyclopédie libre. 15 mars 2017, 19:36 UTC. Disponible sur: wikipedia.org/ Consulté le 18 février 2019.
- Laboratoires BD. Gélose Baird Parker. 2006. Disponible sur: bd.com
- Laboratoires Britannia. Base de gélose Baird Parker. 2015. Disponible sur: britanialab.com
- Laboratoires Francisco Soria Melguizo. 2009. Gélose Baird Parker. Disponible sur: http://f-soria.es/Inform
- Laboratoires Britannia. Tellurite de potassium. 2015. Disponible sur: britanialab.com
- Alarcón-Lavín M, Oyarzo C, Escudero C, Cerda-Leal F, Valenzuela F. Staphylococcus aureus entérotoxigène de type A, dans les écouvillons nasopharyngés chez les manipulateurs d'aliments. Rev Med Chili 2017; 145: 1559-1564
- Covenin standard vénézuélien 1292-89. (1989). Aliments. Isolement et comptage Staphylococcus aureus. Disponible en:sencamer.gob.ve



Personne n'a encore commenté ce post.