
Justification, préparation et utilisations de la gélose XLD
le Gélose XLD ou Xylose Lysine Deoxycholate Agar est un milieu de culture solide sélectif et différentiel pour l'isolement des entéropathogènes. Taylor a conçu la formule de gélose XL (Xylose, Lysine) afin d'améliorer l'isolement du genre Shigella.
Il a observé que ce genre était inhibé dans la plupart des milieux destinés à l'isolement des entéropathogènes. Par la suite, du désoxycholate de sodium, du thiosulfate de sodium et du citrate d'ammonium ferrique ont été ajoutés pour augmenter sa sélectivité. Cette formule s'est avérée utile à la fois pour l'isolement de Shigella et Salmonella.
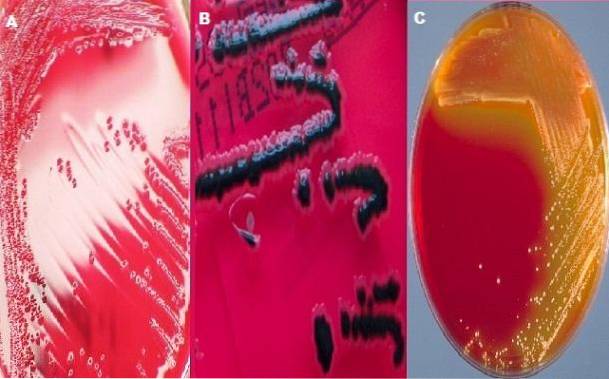
La gélose XLD est composée d'extrait de levure, de désoxycholate de sodium, de xylose, de lysine, de lactose, de saccharose, de thiosulfate de sodium, de citrate d'ammonium ferrique, de chlorure de sodium, de rouge de phénol et d'agar. Dans la plupart des laboratoires de bactériologie, la gélose duo XLD et la gélose SS sont utilisées pour étudier les échantillons fécaux de Shigella et Salmonella..
D'autres laboratoires préfèrent la combinaison de CHROMagar Salmonella et de la gélose XLD, entre autres options disponibles. Ces duos peuvent être préparés dans des boîtes de Pétri doubles. D'un côté, ils placent de la gélose XLD et de l'autre côté de l'autre milieu choisi.
Index des articles
- 1 Justification
- 1.1 -Puissance nutritive
- 1.2 -Sélectivité du milieu
- 1.3 -Puissance différentielle
- 1.4 -Chlorure de sodium, gélose et rouge de phénol
- 2 Préparation
- 3 utilisations
- 3.1 Types d'échantillons
- 3.2 Conditions de semis et d'identification
- 4 Contrôle qualité
- 5 Considérations finales
- 6 Références
Base
-Pouvoir nourrissant
La gélose XLD contient de l'extrait de levure, qui sert de source de nutriments pour les micro-organismes qui se développent sur cette gélose. De plus, la présence de glucides (xylose, saccharose et lactose) fournit de l'énergie aux bactéries qui peuvent les fermenter.
-Sélectivité du milieu
En tant que substance inhibitrice, il contient du désoxycholate de sodium; Cela empêche la croissance des bactéries Gram positives, rendant le milieu sélectif.
-Puissance différentielle
Colonies typiques de Shigella
Comme déjà mentionné, la gélose XLD contient du xylose; Ce glucide est fermenté par toutes les bactéries qui poussent dans ce milieu à l'exception du genre Shigella..
C'est l'une des caractéristiques qui lui confère son caractère différentiel, puisque les colonies de Shigella se distinguent des autres en développant des colonies rouges, tandis que les autres bactéries produisent des colonies jaunes.
Colonies typiques de Salmonella
Le genre Salmonella fermente également le xylose, générant initialement des colonies jaunes. Cependant, après avoir épuisé le xylose glucidique, il attaque la lysine pour son enzyme lysine décarboxylase. La décarboxylation de la lysine génère des alcalis qui transforment la couleur de la colonie et du milieu environnant en rouge d'origine.
Ce comportement n'est réalisé que par Salmonella, car les coliformes qui décarboxylent la lysine sont incapables d'alcaliniser le milieu. En effet, les coliformes fermentent également le lactose et le saccharose présents; par conséquent, la production d'acides est très élevée, laissant la colonie jaune dans ces bactéries.
Il est à noter que le genre Salmonella ne fermente pas le saccharose ni le lactose.
Production de HdeuxS
La gélose XLD permet également la détection des espèces de Salmonella qui produisent HdeuxS; Pour cela, il a la source de soufre représentée par le thiosulfate de sodium et un révélateur de réaction qui est le citrate d'ammonium ferrique..
Ce dernier réagit avec le HdeuxS (gaz incolore) et forme un précipité noir visible insoluble de sulfate de fer. En ce sens, les caractéristiques des colonies de salmonelles seront rouges avec un centre noir..
Il convient de noter que pour la réaction de formation de HdeuxOui, un pH alcalin est nécessaire. C'est pourquoi d'autres entérobactéries qui forment HdeuxS ils ne peuvent pas le faire ou ils le font mal dans ce milieu, car la forte acidité qu'ils produisent lors de la fermentation des glucides présents inhibent ou gênent la réaction.
-Chlorure de sodium, gélose et rouge de phénol
Enfin, le chlorure de sodium maintient l'équilibre osmotique; l'agar est l'agent de solidification et le rouge de phénol détecte les changements de pH, tournant la couleur des colonies et du milieu.
préparation
Peser 55 g de milieu XLD déshydraté et dissoudre dans 1 litre d'eau. Chauffer et remuer le mélange jusqu'à ce qu'il atteigne le point d'ébullition. Ne pas surchauffer, car la chaleur endommage le milieu et crée un précipité qui modifie la morphologie des colonies typiques.
Ce milieu ne doit pas être autoclavé. Lors de sa dissolution, il doit être passé dans un bain-marie à 50 ° C. Lors du refroidissement, il doit être servi directement sur des boîtes de Pétri stériles. Ils peuvent être versés dans des assiettes simples ou doubles. Ils sont laissés à solidifier et conservés au réfrigérateur jusqu'à leur utilisation..
Revenu avant utilisation. S'agissant d'un milieu non stérile, il est recommandé de le préparer près de la date de son utilisation..
Le pH final du milieu doit être de 7,4 ± 0,2. La couleur du milieu préparé est rouge orangé, translucide, sans précipité..
Si vous avez une gélose à base de xylose lysine (XL), vous pouvez ajouter du désoxycholate de sodium, du thiosulfate de sodium et du citrate de fer-ammonium. De cette manière, la formule de gélose XLD est obtenue.
Applications
La gélose XLD est utilisée pour la récupération des entéropathogènes, principalement du genre Shigella et secondairement du genre Salmonella. Il est utile pour évaluer les échantillons de selles, d'eau et d'aliments.
Types d'échantillons
Les matières fécales
Les échantillons de selles peuvent être semés directement sur gélose XLD, faisant une bonne distribution du matériel pour obtenir des colonies isolées.
Pour améliorer la récupération de Salmonella, la gélose XLD peut être semée à partir de milieux d'enrichissement de Salmonella..
Aliments
Dans le cas des aliments, des bouillons d'enrichissement pour Salmonella et Shigella peuvent être utilisés. Pour Salmonella, vous pouvez utiliser un bouillon de sélénite cystine, un bouillon tétrathionate vert clair, entre autres..
Dans le cas de Shigella, il peut être enrichi en bouillon de Shigella avec 0,5 µ / ml de novobiocine, incubé à 42 ° ± 1 ° C pendant 16-20 heures.
L'eau
Dans l'analyse de l'eau, la technique de filtration sur membrane et l'utilisation de gélose XLD sont recommandées, entre autres..
Conditions de semis et d'identification
Le milieu ensemencé est incubé en aérobiose à 35 ° C pendant 24 à 48 heures..
Les colonies typiques de chaque genre sont observées, les colonies suspectes doivent subir des tests biochimiques pour leur identification.
Contrôle de qualité
Les souches bactériennes suivantes peuvent être utilisées pour évaluer le contrôle qualité du milieu: Salmonella typhimurium ATCC 14028, Salmonella enteritidis ATCC 13076, Salmonella abony DSM 4224, Shigella flexneri ATCC 12022, Shigella sonnei ATCC 25931, Escherichia coli ATCC 25922, Proteus mirabilis ATCC 43071, Klebsiella pneumoniae ATCC 33495.
Le genre Salmonella se caractérise en présentant dans ce milieu des colonies rouges avec un centre noir ou des colonies complètement noires. Alors que, dans le genre Shigella, les colonies doivent être rouges, c'est-à-dire la couleur du milieu.
Dans le cas de Escherichia coli on s'attend à ce qu'il soit totalement ou partiellement inhibé; s'il grandit, les colonies sont jaunes. Afin de Proteus mirabilis une mauvaise croissance est attendue avec des colonies roses avec ou sans centre noir. Finalement, le genre Klebsiella se développera sous forme de colonies jaunes.
Dernières pensées
La gélose XLD est largement utilisée dans les laboratoires de bactériologie en raison de sa grande efficacité pour la récupération de Shigella et a également une bonne récupération du genre Salmonella.
Rall et al. (2005) dans leurs travaux intitulés «Evaluation de trois bouillons d'enrichissement et de cinq milieux solides pour la détection de Salmonella chez la volaille» ont démontré celui des 3 milieux classiques testés (gélose vert clair, gélose SS et gélose XLD), XLD l'agar avait le meilleur taux de récupération.
Les pourcentages de récupération étaient les suivants: 13,8% pour l'agar vert clair, 27,6% pour SS et 34,5% pour XLD. Il n'a été surpassé que par la gélose de milieu chromogène Rambach avec 48% de récupération et le CHROMagar avec 79,3%.
Les références
- Maladies d'origine alimentaire. Shigellose. Disponible sur: anmat.gov.ar
- «Gélose XLD». Wikipedia, l'encyclopédie libre. 9 févr.2019, 11:46 UTC. 10 avril 2019, 19:25 wikipedia.org
- Laboratoires BBL. CHROMagar Salmonella / BD XLD Agar (biplate). 2013 Disponible sur: bd.com
- Lab. Neogen. Gélose XLD. Disponible sur: foodsafety.neogen
- Laboratoire Francisco Soria Melguizo. Gélose XLD. Disponible sur: http://f-soria.es/Inform
- Rall L, Rall R, Aragon C, Silva M. Évaluation de trois bouillons d'enrichissement et de cinq milieux de placage pour la détection de Salmonella chez la volaille. Braz. J. Microbiol. 2005; 36 (2): 147-150. Disponible sur: scielo.br
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnostic microbiologique Bailey & Scott. 12 éd. Éditorial Panamericana S.A. Argentine.


Personne n'a encore commenté ce post.