
Structure, propriétés, risques et utilisations de l'alcool butylique tertiaire
le alcool butylique tertiaire est un composé organique dont la formule est (CH3)3COH ou t-BuOH. C'est l'alcool tertiaire le plus simple de tous. En fonction de la température ambiante, il se présente sous la forme d'un solide ou d'un liquide incolore. L'image ci-dessous montre, par exemple, ses cristaux incolores.
Cet alcool n'est pas un substrat de l'enzyme déshydrogénase alcoolique, ni de l'activité peroxydase de la catalase, il est donc classé comme alcool non métabolisable. En raison de ses propriétés biochimiques, on pense qu'il pourrait être utile dans la détection de radicaux hydroxyles in vivo dans des cellules intactes..

C'est l'un des quatre isomères de l'alcool isobutylique, l'isomère étant le moins sensible à l'oxydation et le moins réactif. Dans la nature, on le trouve dans les pois chiches et le manioc ou le manioc, une racine qui est fermentée pour produire des boissons alcoolisées..
L'alcool butylique tertiaire est très soluble dans l'eau et les solvants organiques. Son utilisation principale est comme solvant, remplissant ce rôle dans la production de plastiques, de parfums, de décapants de peinture, etc..
Comme beaucoup de composés organiques, il est un peu toxique, mais à fortes doses, il a un effet narcotique, caractérisé par des maux de tête, des étourdissements, des étourdissements, des étourdissements et des étourdissements..
Index des articles
- 1 Structure de l'alcool tert-butylique
- 2 propriétés
- 2.1 Noms chimiques
- 2.2 Formule moléculaire
- 2.3 Poids moléculaire
- 2.4 Description physique
- 2.5 Odeur
- 2.6 Point d'ébullition
- 2.7 Point de fusion
- 2.8 Point d'éclair
- 2.9 Solubilité dans l'eau
- 2.10 Solubilité dans les solvants organiques
- 2.11 Densité
- 2.12 Densité de vapeur
- 2.13 Pression de vapeur
- 2.14 Coefficient de partage octanol / eau
- 2.15 Thermostabilité
- 2.16 Température d'auto-inflammation
- 2.17 Décomposition
- 2.18 Chaleur de vaporisation
- 2.19 Capacité calorique
- 2.20 Enthalpie de formation
- 2.21 Température de stockage
- 2.22 Stabilité
- 2.23 Potentiel d'ionisation
- 2.24 Seuil olfactif
- 2.25 Indice de réfraction
- 2.26 Constante de dissociation
- 2.27 Concentration maximale de vapeur
- 2.28 Réactions
- 3 risques
- 4 utilisations
- 5 Références
Structure de l'alcool tert-butylique
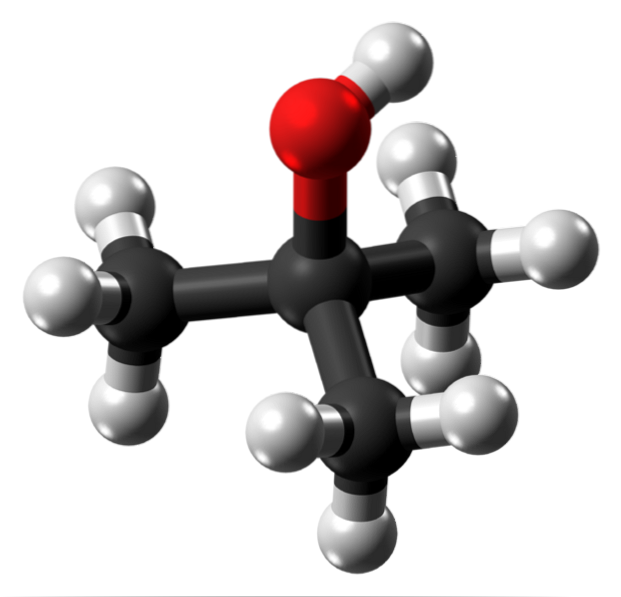
L'image du haut montre la structure moléculaire de l'alcool tert-butylique avec un modèle de sphères et de barres. La molécule entière a une géométrie tétraédrique globale, avec le 3ème carbone situé en son centre, et les groupes CH3 et OH à ses sommets.
En observant cette structure, on comprend pourquoi cet alcool est tertiaire: le carbone au centre est lié à trois autres carbones. Poursuivant avec le tétraèdre, la partie inférieure de celui-ci peut être considérée comme apolaire, tandis que son sommet supérieur, polaire.
À ce sommet se trouve le groupe OH, qui crée un moment dipolaire permanent et permet également aux molécules t-BuOH d'interagir par le biais de liaisons hydrogène; de la même manière que pour les molécules d'eau et autres substances polaires.
Dans les cristaux de t-BuOH, ces liaisons hydrogène sont un facteur clé pour que les molécules restent ensemble; bien qu'il n'y ait pas beaucoup d'informations sur la structure cristalline de cet alcool.
Comme le groupe OH est si proche et entouré par les groupes apolaires CH3, les molécules d'eau parviennent à hydrater presque tout l'alcool en même temps qu'elles interagissent avec l'OH. Cela expliquerait sa grande solubilité dans l'eau..
Propriétés
Noms chimiques
-Alcool butylique tertiaire
-tert-butanol
-2- méthyl-2-propanol
-2-méthylpropane-2-ol.
Formule moléculaire
C4HdixO ou (CH3)3COH.
Poids moléculaire
74,123 g / mol.
Description physique
Solide incolore ou liquide incolore, selon la température ambiante, puisque le point de fusion est de 77,9 ° F (25,4 ° C). Au-dessus de 77,9 ° F, c'est un liquide.
Odeur
Similaire au camphre.
Point d'ébullition
82,4 ºC.
Point de fusion
77,9 ºF (25,4 ºC).
point d'allumage
52 ° F (11 ° C). Coupe fermée.
Solubilité dans l'eau
Très soluble. En effet, quelles que soient les proportions, cet alcool est toujours miscible à l'eau..
Solubilité dans les solvants organiques
Miscible avec l'éthanol, l'éther éthylique et soluble dans le chloroforme.
Densité
0,78 g / cm3.
Densité de vapeur
2,55 (par rapport à l'air = 1).
La pression de vapeur
4,1 kPa à 20 ºC.
Coefficient de partage octanol / eau
Log P = 0,35.
Thermostabilité
Instable dans la chaleur
La température d'auto-inflammation
896 ºF (470 ºC).
Décomposition
Lorsqu'il est chauffé, il peut libérer du monoxyde de carbone et des vapeurs d'isobutylène.
Chaleur de vaporisation
39,07 kJ / mol.
Capacité calorique
215,37 JK-1Môle-1.
Enthalpie de formation
-360,04 à -358,36 kJmol-1.
Température de stockage
2 à 8 ºC.
Stabilité
Il est stable, mais incompatible avec les agents oxydants puissants, le cuivre, les alliages de cuivre, les métaux alcalins et l'aluminium.
Potentiel d'ionisation
9,70 eV.
Seuil d'odeur
219 mg / m3 (une faible odeur).
Indice de réfraction
1382 à 25 ºC.
Constante de dissociation
pKa = 19,20.
Concentration maximale de vapeur
5,53% à 25 ºC.
Réactions
-Il est déprotoné par une base forte pour donner naissance à un anion alcoxyde; spécifiquement, un terbutoxyde, (CH3)3CO-.
-L'alcool tert-butylique réagit avec le chlorure d'hydrogène pour former du chlorure de tert-butyle..
(CH3)3COH + HCl => (CH3)3CCl + HdeuxOU ALORS
Les alcools tertiaires ont une plus grande réactivité avec les halogénures d'hydrogène que les alcools secondaires et primaires.
Des risques
L'alcool tert-butylique en contact avec la peau provoque des lésions mineures, telles qu'un érythème non sévère et une hyperémie. De plus, il ne traverse pas la peau. Au contraire, dans les yeux, il produit une irritation sévère.
Lorsqu'il est inhalé, il irrite le nez, la gorge et les bronches. En cas d'exposition élevée, des effets narcotiques, un état de somnolence, ainsi que des étourdissements, des étourdissements et des maux de tête peuvent survenir..
Cet alcool est un agent tératogène expérimental, c'est pourquoi il a été observé chez l'animal qu'il peut influencer l'apparition de troubles congénitaux.
Concernant son stockage, son liquide et ses vapeurs sont inflammables, et donc dans certaines circonstances il peut générer des incendies et des explosions..
L'OSHA a établi une limite de concentration de 100 ppm (300 mg / m3) pour un quart de 8 heures.
Applications
-L'alcool tert-butylique est utilisé pour l'incorporation du groupement tert-butyle dans des composés organiques, afin de préparer des résines solubles dans l'huile, et le trinitro-tert-butyltoluène, un musc artificiel. De plus, il constitue une matière première pour la préparation de peroxydes.
-Il a été approuvé par la FDA comme agent anti-mousse pour une utilisation sur les matières plastiques et les composants qui entrent en contact avec les aliments. Il a été utilisé dans la production d'essences de fruits, de plastiques et de laques.
-C'est un intermédiaire pour la production de chlorure de tert-butyle et de tributylphénol. Agit comme un agent dénaturant de l'éthanol.
-Il est utilisé pour la fabrication d'agents de flottation, comme solvant organique pour éliminer les peintures et pour dissoudre les essences utilisées dans les parfums..
-Il est utilisé comme exhausteur d'octane dans l'essence; carburant et additif pour carburant; solvant à utiliser pour le nettoyage et comme dégraissant.
-L'alcool tert-butylique est un agent intermédiaire dans la production d'éther tert-butylméthylique (MTBE) et d'éther tributyléthylique (ETBE), réagissant respectivement avec le méthanol et l'éthanol.
-Il agit également de la même manière dans la production d'hydroperoxyde de tributyle (TBHP) par réaction avec le peroxyde d'hydrogène..
-Il est utilisé comme réactif dans le processus connu sous le nom de réarrangement de Curtius..
Les références
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (dixe édition.). Wiley plus.
- Wikipédia. (2019). Alcool tert-butylique. Récupéré de: en.wikipedia.org
- CommonOrganicChemistry. (s.f.). t-butanol. Récupéré de: commonorganicchemistry.com
- Centre national d'information sur la biotechnologie. (2019). Tert butanol. Base de données PubChem. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Carey F. A. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.



Personne n'a encore commenté ce post.