
Structure, propriétés, utilisations et exemples des aldéhydes

Les aldéhydes ce sont des composés organiques de formule générale RCHO. R représente une chaîne aliphatique ou aromatique; C au carbone; O en oxygène et H en hydrogène. Ils sont caractérisés par un groupe carbonyle comme les cétones et les acides carboxyliques, c'est pourquoi les aldéhydes sont également appelés composés carbonylés..
Le groupe carbonyle confère à l'aldéhyde plusieurs de ses propriétés. Ce sont des composés facilement oxydables et très réactifs aux additions nucléophiles. La double liaison du groupe carbonyle (C = O) a deux atomes qui ont des différences dans leur avidité pour les électrons (électronégativité).
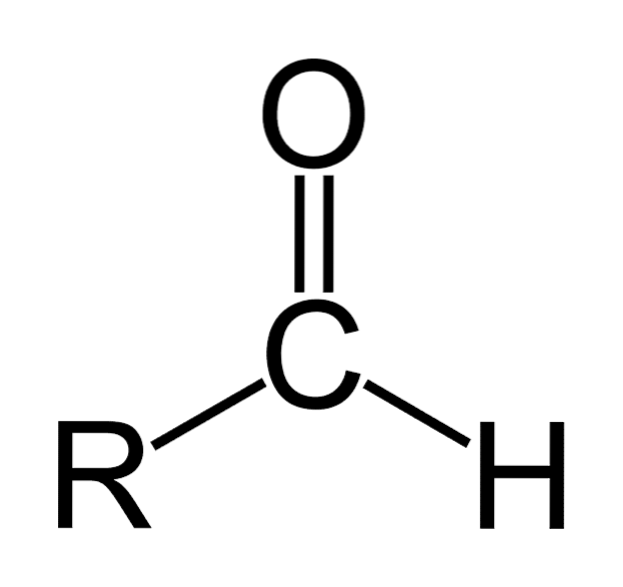
L'oxygène attire les électrons avec une force plus grande que le carbone, de sorte que le nuage d'électrons se déplace vers lui, rendant la double liaison entre le carbone et l'oxygène de nature polaire, avec un moment dipolaire significatif. Cela fait des aldéhydes des composés polaires..
La polarité des aldéhydes influencera leurs propriétés physiques. Le point d'ébullition et la solubilité des aldéhydes dans l'eau sont plus élevés que les composés chimiques non polaires ayant des poids moléculaires similaires, comme c'est le cas des hydrocarbures..
Les aldéhydes avec moins de cinq atomes de carbone sont solubles dans l'eau, car des liaisons hydrogène se forment entre l'oxygène du groupe carbonyle et la molécule d'eau. Cependant, l'augmentation du nombre de carbones dans la chaîne hydrocarbonée produit une augmentation de la partie non polaire de l'aldéhyde, le rendant moins soluble dans l'eau..
Mais comment sont-ils et d'où viennent-ils? Bien que sa nature dépende essentiellement du groupe carbonyle, le reste de la structure moléculaire contribue également beaucoup à l'ensemble. Ainsi, ils peuvent être de toute taille, petite ou grande, voire une macromolécule peut avoir des régions où le caractère des aldéhydes prédomine..
Ainsi, comme pour tous les composés chimiques, il existe des aldéhydes «agréables» et d'autres amers. Ils peuvent être trouvés dans des sources naturelles ou synthétisés à grande échelle. Des exemples d'aldéhydes sont la vanilline, très présente dans les crèmes glacées (image du haut), et l'acétaldéhyde, qui ajoute de la saveur aux boissons alcoolisées..
Index des articles
- 1 Structure chimique
- 2 Propriétés physiques et chimiques
- 2.1 Points de fusion
- 2.2 Points d'ébullition
- 2.3 Solubilité dans l'eau exprimée en g / 100 g de H2O
- 3 Réactivité
- 3.1 Réaction d'oxydation
- 3.2 Réduction des alcools
- 3.3 Réduction des hydrocarbures
- 3.4 Addition nucléophile
- 4 Nomenclature
- 5 utilisations
- 5.1 Formaldéhyde
- 5.2 Bakélite
- 5.3 Contreplaqué
- 5.4 Polyuréthane
- 5,5 Butyraldéhyde
- 5.6 Acétaldéhyde
- 5.7 Synthèse
- 6 Exemples d'aldéhydes
- 6.1 Glutaraldéhyde
- 6.2 Benzaldéhyde
- 6.3 Glycéraldéhyde
- 6.4 Glycéraldéhyde-3-phosphate
- 6,5 11-cis-rétinien
- 6.6 Phosphate de pyridoxal (vitamine B6)
- 6.7 Salicylaldéhyde
- 7 Références
Structure chimique

Les aldéhydes sont constitués d'un carbonyle (C = O) auquel un atome d'hydrogène est directement lié. Cela le différencie des autres composés organiques tels que les cétones (RdeuxC = O) et acides carboxyliques (RCOOH).
L'image du haut montre la structure moléculaire autour de -CHO, un groupe formyle. Le groupe formyle est plat car le carbone et l'oxygène ont une hybridation spdeux. Cette planéité le rend susceptible d'être attaqué par des espèces nucléophiles, et par conséquent il est facilement oxydé..
À quoi fait référence cette oxydation? À la formation d'une liaison avec tout autre atome plus électronégatif que le carbone; et dans le cas des aldéhydes, c'est un oxygène. Ainsi, l'aldéhyde est oxydé en un acide carboxylique, -COOH. Et si l'aldéhyde était réduit? Un alcool primaire se formerait à sa place, ROH.
Les aldéhydes ne sont produits qu'à partir d'alcools primaires: ceux dont le groupement OH est en bout de chaîne. De même, le groupe formyle toujours est à la fin d'une chaîne ou dépasse de celle-ci ou du cycle en tant que substituant (s'il existe d'autres groupes plus importants, tels que -COOH).
Proprietes physiques et chimiques
Comme ce sont des composés polaires, leurs points de fusion sont plus élevés que ceux des composés non polaires. Les molécules d'aldéhyde ne sont pas capables de liaison intermoléculaire via des liaisons hydrogène, car elles n'ont que des atomes de carbone liés à des atomes d'hydrogène..
En raison de ce qui précède, les aldéhydes ont des points d'ébullition inférieurs à ceux des alcools et des acides carboxyliques.
Point de fusion
Formaldéhyde -92; Acétaldéhyde -121; Propionaldéhyde -81; n-butyraldéhyde -99; n-valéraldéhyde-91; Caproaldéhyde -; Heptaldéhyde - 42; Phénylacétaldéhyde -; Benzaldéhyde -26.
Points d'ébullition
Formaldéhyde -21; Acétaldéhyde 20; Propionaldéhyde 49; n-butyraldéhyde 76; n-valéraldéhyde 103; Caproaldéhyde 131; Heptaldéhyde 155; Phénylacétaldéhyde 194; Benzaldéhyde 178.
Solubilité dans l'eau exprimée en g / 100 g de HdeuxOU ALORS
Formaldéhyde, très soluble; Acétaldéhyde, infini; Propionaldéhyde, 16; n-butyraldéhyde, 7; n-valéraldéhyde, légèrement soluble; caproaldéhyde, légèrement soluble; Phénylacétaldéhyde légèrement soluble; Benzaldéhyde, 0,3.
Les points d'ébullition des aldéhydes ont tendance à augmenter directement avec le poids moléculaire. Au contraire, il existe une tendance à diminuer la solubilité des aldéhydes dans l'eau à mesure que leur poids moléculaire augmente. Cela se reflète dans les constantes physiques des aldéhydes que nous venons de mentionner..
Réactivité
Réaction d'oxydation
Les aldéhydes peuvent être oxydés en l'acide carboxylique correspondant en présence de l'un de ces composés: Ag (NH3)deux, KMnO4 d'accorddeuxCrdeuxOU ALORS7.
Réduction aux alcools
Ils peuvent être hydrogénés à l'aide de catalyseurs au nickel, au platine ou au palladium. Ainsi, le C = O devient C-OH.
Réduction des hydrocarbures
En présence de Zn (Hg), HCl concentré ou en NHdeuxNHdeux les aldéhydes perdent le groupe carbonyle et deviennent des hydrocarbures.
Ajout nucléophile
Il existe plusieurs composés qui sont ajoutés au groupe carbonyle, parmi lesquels: les réactifs de Grignard, le cyanure, les dérivés de l'ammoniac et les alcools.
Nomenclature
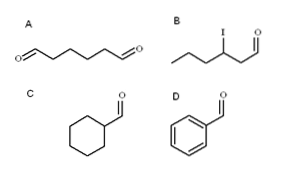
Quatre aldéhydes sont illustrés dans l'image ci-dessus. Comment sont-ils nommés?
Puisqu'il s'agit d'alcools primaires oxydés, le nom de l'alcool passe de -ol à -al. Ainsi, le méthanol (CH3OH) si oxydé en CH3CHO est appelé méthanal (formaldéhyde); CH3CHdeuxCHO éthanal (acétaldéhyde); CH3CHdeuxCHdeuxCHO propanal et CH3CHdeuxCHdeuxCHdeuxCHO butanal.
Tous les aldéhydes nouvellement nommés ont le groupe -CHO à la fin de la chaîne. Lorsqu'il est trouvé aux deux extrémités, comme dans A, la terminaison -al est précédée du préfixe di-. Comme A a six carbones (en comptant ceux des deux groupes formyle), il dérive du 1-hexanol et son nom est donc: hexanecadran.
Lorsqu'il y a un substituant, tel qu'un radical alkyle, une double ou triple liaison, ou un halogène, les carbones de la chaîne principale sont listés en donnant -CHO le numéro 1. Ainsi, l'aldéhyde B est appelé: 3-iodohexanal.
Cependant, dans les aldéhydes C et D, le groupe -CHO n'a pas la priorité pour identifier ces composés parmi d'autres. C est un cycloalcane, tandis que D un benzène, tous deux avec l'un de leurs H substitué par un groupe formyle.
En eux, comme la structure principale est cyclique, le groupe formyle est appelé carbaldéhyde. Ainsi, C est le cyclohexanecarbaldéhyde et D est le benzènecarbaldéhyde (mieux connu sous le nom de benzaldéhyde).
Applications
Il existe dans la nature des aldéhydes capables de conférer des saveurs agréables, tel est le cas du cinnamaldéhyde, responsable de la saveur caractéristique de la cannelle. C'est pourquoi ils sont souvent utilisés comme arômes artificiels dans de nombreux produits tels que les bonbons ou les aliments..
Formaldéhyde
Le formaldéhyde est l'aldéhyde le plus produit industriellement. Le formaldéhyde obtenu par oxydation du méthanol est utilisé dans une solution à 37% du gaz dans l'eau, sous le nom de formaline. Ceci est utilisé dans le tannage des peaux et dans la conservation et l'embaumement des cadavres..
De même, le formaldéhyde est utilisé comme germicide, fongicide et insecticide pour les plantes et les légumes. Cependant, sa plus grande utilité est la contribution à la production de matériau polymère. Le plastique appelé bakélite est synthétisé par la réaction entre le formaldéhyde et le phénol.
Bakélite
La bakélite est un polymère très dur avec une structure tridimensionnelle utilisée dans de nombreux ustensiles ménagers tels que les poignées de casseroles, poêles, cafetières, couteaux, etc..
Les polymères de type bakélite sont fabriqués à partir de formaldéhyde en combinaison avec les composés urée et mélamine. Ces polymères sont utilisés non seulement comme plastiques, mais également comme colles adhésives et matériau de revêtement..
Contre-plaqué
Le contreplaqué est le nom commercial d'un matériau formé de fines feuilles de bois, jointes par des polymères produits à partir de formaldéhyde. Les marques Formica et Melmac sont fabriquées avec la participation de ce dernier. Le formica est une matière plastique utilisée dans le revêtement de meubles.
Le plastique Melmac est utilisé pour fabriquer des assiettes, des verres, des tasses, etc. Le formaldéhyde est la matière première pour la synthèse du composé méthylène-diphényl-diisocyanate (MDI), un précurseur du polyuréthane.
Polyuréthane
Le polyuréthane est utilisé comme isolant dans les réfrigérateurs et les congélateurs, rembourrage pour meubles, matelas, revêtements, adhésifs, semelles, etc..
Butyraldéhyde
Le butyraldéhyde est le principal précurseur de la synthèse du 2-éthylhexanol, qui est utilisé comme plastifiant. Il a un agréable arôme de pomme qui permet son utilisation dans les aliments comme arôme.
Il est également utilisé pour la production d'accélérateurs en caoutchouc. Intervient comme réactif intermédiaire dans la fabrication de solvants.
Acétaldéhyde
L'acétaldéhyde a été utilisé dans la production d'acide acétique. Mais ce rôle de l'acétaldéhyde a diminué en importance, car il a été déplacé par le processus de carbonylation du méthanol..
La synthèse
D'autres aldéhydes sont des précurseurs d'oxoalcools, qui sont utilisés dans la production de détergents. Les soi-disant oxoalcools sont préparés en ajoutant du monoxyde de carbone et de l'hydrogène à une oléfine pour obtenir un aldéhyde. Et enfin l'aldéhyde est hydrogéné pour obtenir l'alcool.
Certains aldéhydes sont utilisés dans la fabrication de parfums, comme c'est le cas avec Chanel n ° 5. De nombreux aldéhydes d'origine naturelle ont des odeurs agréables, par exemple: l'heptanal a une odeur d'herbe verte; l'octanal une odeur d'orange; le nonanal une odeur de roses et le citral une odeur de citron vert.
Exemples d'aldéhydes
Glutaraldéhyde
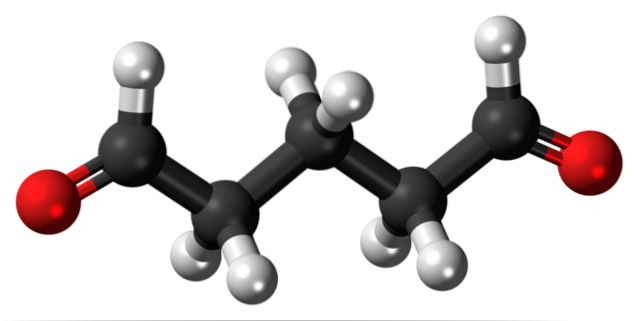
Le glutaraldéhyde a deux groupes formyle dans sa structure aux deux extrémités.
Commercialisé sous le nom de Cidex ou Glutaral, il est utilisé comme désinfectant pour stériliser les instruments chirurgicaux. Il est utilisé pour traiter les verrues sur les pieds, en l'appliquant sous forme de liquide. Il est également utilisé comme agent de fixation tissulaire dans les laboratoires d'histologie et de pathologie..
Benzaldéhyde
C'est l'aldéhyde aromatique le plus simple qui est formé par un cycle benzénique où un groupe formyle est lié.
On la retrouve dans l'huile d'amande, d'où son odeur caractéristique qui lui permet d'être utilisée comme arôme alimentaire. De plus, il est utilisé dans la synthèse de composés organiques liés à la fabrication de médicaments et à la fabrication de plastiques..
Glycéraldéhyde
C'est un aldotriose, un sucre composé de trois atomes de carbone. Il possède deux isomères appelés énantiomères D et L. Le glycéraldéhyde est le premier monosaccharide à être obtenu en photosynthèse pendant la phase sombre (cycle de Calvin)..
Glycéraldéhyde-3-phosphate
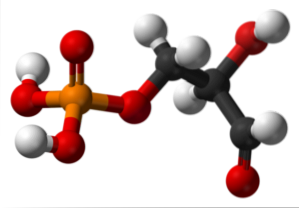
L'image du haut illustre la structure du glycéraldéhyde-3-phosphate. Les sphères rouges à côté de la jaune correspondent au groupe phosphate, tandis que les noires au squelette carboné. La sphère rouge liée à la blanche est le groupe OH, mais lorsqu'elle est liée à la sphère noire et cette dernière à la blanche, alors c'est le groupe CHO.
Le glycéraldéhyde-3-phosphate est impliqué dans la glycolyse, un processus métabolique dans lequel le glucose est dégradé en acide pyruvique avec la production d'ATP, un réservoir d'énergie des êtres vivants. En plus de la production de NADH, un réducteur biologique.
Dans la glycolyse, le glycéraldéhyde-3-phosphate et le dihydroacétone phosphate proviennent du clivage du D-fructose-1-6-bisphosphate
Le glycéraldéhyde-3-phosphate est impliqué dans le processus métabolique connu sous le nom de cycle du pentose. Dans celui-ci, NADPH, un réducteur biologique important, est généré..
11-cis-rétinien
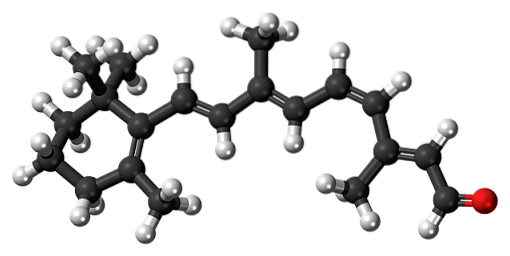
Le Β-carotène est un pigment naturel présent dans divers légumes, en particulier les carottes. Il subit une dégradation oxydative dans le foie, se transformant ainsi en alcool rétinol ou en vitamine A. L'oxydation de la vitamine A et l'isomérisation consécutive de l'une de ses doubles liaisons forment l'aldéhyde 11-cis-rétinien.
Phosphate de pyridoxal (vitamine B6)
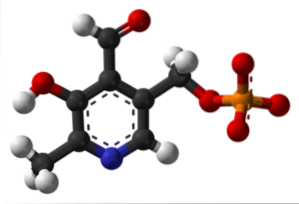
C'est un groupe prothétique lié à plusieurs enzymes, qui est la forme active de la vitamine B6 et participe au processus de synthèse du neurotransmetteur inhibiteur GABA.
Où est le groupe formyle dans votre structure? Notez que cela diffère du reste des groupes liés au cycle aromatique.
Salicylaldéhyde
C'est une matière première pour la synthèse de l'acide acétylsalicylique, un médicament analgésique et antipyrétique connu sous le nom d'aspirine..
Les références
- Robert C. Neuman, Jr. Chapitre 13, Composés carbonylés: cétones, aldéhydes, acides carboxyliques. [PDF]. Tiré de: chem.ucr.edu
- Germán Fernández. (14 septembre 2009). Nomenclature des aldéhydes. Tiré de: quimicaorganica.net
- T.W. Graham Solomons, Craigh B. Fryhle. Chimie organique. (Dixième édition, p 729-731) Wiley Plus.
- Jerry March et William H. Brown. (31 décembre 2015). Aldéhyde. Tiré de: britannica.com
- Wikipédia. (2018). Aldéhydes. Tiré de: https://en.wikipedia.org/wiki/Aldehyde
- Morrison, R. T. et Boyd, R. N. (1990). Chimie organique Cinquième édition. Éditorial Addison-Wesley Iberoamericana.
- Carey, F. A. (2006). Chimie organique, sixième édition. Maison d'édition Mc Graw Hill.
- Mathews, Ch. K., Van Holde, K. E. et Athern, K. G. (2002). Biochimie. Troisième édition. Éditeur Pearson Adisson Wesley.


Personne n'a encore commenté ce post.