
Allotropie, transformation allotropique et principaux éléments

La allotropie en chimie, c'est la particularité que certains éléments chimiques ont de se présenter sous plusieurs formes différentes mais dans le même état d'agrégation de matière. La structure des éléments peut varier en fonction de leur disposition moléculaire et des conditions dans lesquelles ils sont formés, telles que la pression et la température..
Ce n'est que lorsqu'il s'agit d'éléments chimiques que le mot allotropie est utilisé, désignant chacune des façons dont un élément peut être trouvé dans la même phase comme allotrope; que pour les composés présentant des structures cristallines différentes, il ne s'applique pas; dans ce cas on parle de polymorphisme.
D'autres cas sont connus, comme celui de l'oxygène, dans lesquels l'allotropie peut se produire sous la forme d'une modification du nombre d'atomes de la substance. En ce sens, il existe une notion de deux allotropes de cet élément, mieux connus sous le nom d'oxygène (Odeux) et l'ozone (O3).
Index des articles
- 1 Transformation allotropique
- 2 Principaux éléments allotropes
- 2.1 Carbone
- 2.2 Soufre
- 2.3 Phosphore
- 2.4 Oxygène
- 3 Références
Transformation allotropique
Comme mentionné précédemment, les allotropes sont les différentes façons dont le même élément peut être trouvé, de sorte que cette variation de sa structure fait apparaître ces espèces avec des caractéristiques physiques et chimiques différentes..
De même, la transformation allotropique entre un élément et un autre se produit par la manière dont les atomes sont disposés à l'intérieur des molécules; c'est-à-dire la manière dont le lien prend naissance.
Ce changement entre un allotrope et un autre peut se produire pour différentes raisons, telles que des changements dans les conditions de pression, de température et même d'incidence du rayonnement électromagnétique tel que la lumière..
Lorsque la structure d'une espèce chimique est altérée, elle peut également modifier son comportement, en modifiant des propriétés telles que sa conductivité électrique, sa dureté (dans le cas de substances solides), son point de fusion ou d'ébullition et même des qualités physiques telles que sa couleur..
De plus, l'allotropie peut être de deux types:
- Monotrope, lorsque l'une des structures d'élément a une plus grande stabilité que les autres dans toutes les conditions.
- Énanthropique, lorsque les différentes structures sont stables dans des conditions différentes mais peuvent se transformer l'une en l'autre de manière réversible à certaines pressions et températures.
Principaux éléments allotropes
Bien qu'il existe plus d'une centaine d'éléments connus dans le tableau périodique, tous n'ont pas de formes allotropes. Les allotropes les plus connus sont présentés ci-dessous.
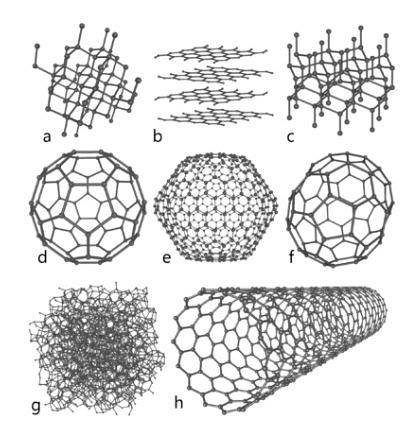
Carbone
Cet élément d'une grande abondance dans la nature représente la base fondamentale de la chimie organique. Plusieurs espèces allotropes sont connues, parmi lesquelles le diamant, le graphite et d'autres qui seront exposés ci-dessous se distinguent..
diamant
Le diamant présente une disposition moléculaire sous forme de cristaux tétraédriques dont les atomes sont liés par des liaisons simples; cela signifie qu'ils sont arrangés par hybridation sp3.
Graphite
Le graphite est composé de feuilles consécutives de carbone, où ses atomes sont liés en structures hexagonales par des doubles liaisons; c'est-à-dire avec l'hybridation spdeux.
Carbino
En plus des deux allotropes importants mentionnés ci-dessus, qui sont les plus connus du carbone, il en existe d'autres comme le carbyne (car le carbone acétylénique linéaire, LAC, est également connu), où ses atomes sont disposés de manière linéaire par des triples liaisons; c'est-à-dire avec l'hybridation sp.
Autres
- Graphène, dont la structure est très similaire au graphite).
- Fullerène ou buckminsterfullerène, également connu sous le nom de buckyball, dont la structure est hexagonale mais ses atomes sont disposés en forme d'anneau.
- Nanotubes de carbone, de forme cylindrique.
- Carbone amorphe, sans structure cristalline.
Soufre
Le soufre a également plusieurs allotropes considérés comme communs, tels que les suivants (il convient de noter que tous sont à l'état solide):
Soufre rhombique
Comme son nom l'indique, sa structure cristalline est composée de losanges octogonaux et est également connue sous le nom de soufre α..
Soufre monoclinique
Connu sous le nom de β soufre, il a la forme d'un prisme composé de huit atomes de soufre.
Soufre fondu
Il produit des cristaux prismatiques stables à certaines températures, formant des aiguilles dépourvues de couleur..
Soufre plastique
Aussi appelé soufre, il a une structure amorphe.
Soufre liquide
Il a des caractéristiques de viscosité contrairement à la plupart des éléments, car dans cet allotrope, il se développe avec l'augmentation de la température.
Correspondre
Cet élément non métallique se trouve couramment dans la nature en combinaison avec d'autres éléments et a plusieurs substances allotropes associées:
Phosphore blanc
C'est un solide à structure cristalline tétraédrique et a des applications dans le domaine militaire, même utilisé comme arme chimique..
Phosphore noir
Il a la stabilité la plus élevée parmi les allotropes de cet élément et est très similaire au graphène.
Phosphore rouge
Forme un solide amorphe aux propriétés réductrices mais dépourvu de toxicité.
Diphosphore
Comme son nom l'indique, il est composé de deux atomes de phosphore et est une forme gazeuse de cet élément.
Phosphore violet
C'est un solide avec une structure cristalline avec un arrangement moléculaire monoclinique..
Phosphore écarlate
Structure amorphe solide également.
Oxygène
Bien qu'il soit l'un des éléments les plus communs de l'atmosphère terrestre et l'un des éléments les plus abondants de l'univers, il possède peu d'allotropes connus, parmi lesquels le dioxygène et le trioxygène se distinguent..
Dioxygène
Le dioxygène est mieux connu sous le simple nom d'oxygène, une substance gazeuse essentielle aux processus biologiques de cette planète..
Trioxygène
Le trioxygène est mieux connu simplement sous le nom d'ozone, un allotrope hautement réactif dont la fonction la plus célèbre est de protéger l'atmosphère terrestre des sources de rayonnement externes..
Tétraoxygène
Forme une phase solide de structure trigonale avec des caractéristiques de métastabilité.
Autres
Il existe également six autres espèces solides que l'oxygène forme, avec différentes structures cristallines..
De la même manière, il existe des éléments tels que le sélénium, le bore, le silicium, entre autres, qui présentent des allotropes différents et qui ont été étudiés avec une profondeur plus ou moins grande..
Les références
- Wikipédia. (s.f.). Allotropie. Récupéré de en.wikipedia.org
- Chang, R. (2007). Chimie, neuvième édition. Mexique: McGraw-Hill.
- Britannica, E. (s.f.). Allotropie. Récupéré de britannica.com
- ThoughtCo. (s.f.). Définition et exemples d'allotrope. Récupéré de thinkco.com
- Ciach, R. (1998). Alliages légers et composites avancés. Obtenu sur books.google.co.ve




Personne n'a encore commenté ce post.