
Propriétés des alcynes, structure, utilisations et exemples
Les alcynes Ce sont des hydrocarbures ou des composés organiques qui ont une triple liaison entre deux carbones dans leurs structures. Cette triple liaison (≡) est considérée comme un groupe fonctionnel car elle représente un site actif de la molécule, et est donc responsable de leur réactivité.
Bien que les alcynes ne soient pas très différents des alcanes ou des alcènes, ils présentent une acidité et une polarité supérieures en raison de la nature de leurs liaisons. Le terme précis pour décrire cette légère différence est ce que l'on appelle insaturation.

Les alcanes sont des hydrocarbures saturés, tandis que les alcynes sont les plus insaturés par rapport à la structure d'origine. Qu'est ce que ça signifie? Qu'un alcane H3C-CH3 (éthane) peut être déshydrogéné en HdeuxC = CHdeux (éthène) et plus tard à HC≡CH (éthyne, ou mieux connu sous le nom d'acétylène).
Notez comment, à mesure que des liaisons supplémentaires se forment entre les carbones, le nombre d'hydrogènes qui leur sont liés diminue. Le carbone, en raison de ses caractéristiques électroniques, cherche à former quatre liaisons simples, donc plus l'insaturation est élevée, plus la tendance à réagir est grande (à l'exception des composés aromatiques).
En revanche, la triple liaison est beaucoup plus forte que la double liaison (=) ou la simple liaison (-), mais à un coût énergétique élevé. Par conséquent, la plupart des hydrocarbures (alcanes et alcènes) peuvent former des triples liaisons à des températures élevées..
En raison des hautes énergies de ceux-ci, et lorsqu'ils se cassent, ils dégagent beaucoup de chaleur. Un exemple de ce phénomène est vu lorsque l'acétylène est brûlé avec de l'oxygène et que la chaleur intense de la flamme est utilisée pour souder ou faire fondre des métaux (image du haut).
L'acétylène est l'alcyne le plus simple et le plus petit de tous. D'autres hydrocarbures peuvent être exprimés à partir de sa formule chimique en remplaçant le H par des groupes alkyles (RC≡CR '). La même chose se passe dans le monde de la synthèse organique à travers un grand nombre de réactions.
Cet alcyne est produit à partir de la réaction de l'oxyde de calcium du calcaire et du coke, une matière première qui fournit les carbones nécessaires dans un four électrique:
CaO + 3C => CaCdeux + CO
Le CaCdeux C'est le carbure de calcium, un composé inorganique qui réagit finalement avec l'eau pour former de l'acétylène:
CaCdeux + 2HdeuxO => Ca (OH)deux + HC≡CH
Index des articles
- 1 Propriétés physiques et chimiques des alcynes
- 1.1 Polarité
- 1.2 Acidité
- 2 Réactivité
- 2.1 Hydrogénation
- 2.2 Ajout d'halogénures d'hydrogène
- 2.3 Hydratation
- 2.4 Ajout d'halogènes
- 2.5 Alkylation de l'acétylène
- 3 Structure chimique
- 3.1 Distance des liaisons et alcynes terminaux
- 4 Nomenclature
- 5 utilisations
- 5.1 Acétylène ou éthyne
- 5.2 Alcynes naturelles
- 6 Exemples d'alcynes
- 6.1 Acide taririque
- 6.2 Histrionicotoxine
- 6.3 Cicutoxine
- 6.4 Capilline
- 6.5 Pargyline
- 7 Références
Propriétés physiques et chimiques des alcynes
Polarité
La triple liaison distingue les alcynes des alcanes et des alcènes. Les trois types d'hydrocarbures sont apolaires, insolubles dans l'eau et acides très faibles. Cependant, l'électronégativité des carbones à double et triple liaison est supérieure à celle des carbones simples..
En conséquence, les carbones adjacents à la triple liaison donnent une densité de charge négative par effet inductif. Pour cette raison, là où se trouvent les liaisons C orC ou C = C, il y aura une densité d'électrons plus élevée que dans le reste du squelette carboné. En conséquence, il y a un petit moment dipolaire par lequel les molécules interagissent par des forces dipôle-dipôle..
Ces interactions sont très faibles si leurs moments dipolaires sont comparés à ceux de la molécule d'eau ou de tout alcool. Cela se reflète dans leurs propriétés physiques: les alcynes ont généralement des points de fusion et d'ébullition plus élevés que leurs hydrocarbures moins insaturés..
De même, en raison de leur faible polarité, ils sont moins insolubles dans l'eau, mais ils sont solubles dans les solvants organiques non polaires comme le benzène..
Acidité
En outre, cette électronégativité provoque l'hydrogène HCLe ≡CR est plus acide que tout autre présent dans les autres hydrocarbures. Par conséquent, les alcynes sont des espèces plus acides que les alcènes et beaucoup plus acides que les alcanes. Cependant, son acidité est encore négligeable par rapport à celle des acides carboxyliques..
Les alcynes étant des acides très faibles, ils ne réagissent qu'avec des bases très fortes, telles que l'amidure de sodium:
HC≡CR + NaNHdeux => HC≡CNa + NH3
A partir de cette réaction, on obtient une solution d'acétylure de sodium, matière première pour la synthèse d'autres alcynes..
Réactivité
La réactivité des alcynes s'explique par l'ajout de petites molécules à leur triple liaison, diminuant leur insaturation. Il peut s'agir de molécules d'hydrogène, d'halogénures d'hydrogène, d'eau ou d'halogènes..
L'hydrogénation
La petite molécule de Hdeux il est très insaisissable et rapide, donc pour augmenter les chances qu'ils soient ajoutés à la triple liaison des alcynes, des catalyseurs doivent être utilisés.
Ce sont généralement des métaux (Pd, Pt, Rh ou Ni) finement divisés pour augmenter la surface; et donc, le contact entre l'hydrogène et l'alcyne:
RC≡CR '+ 2Hdeux => RCHdeuxCHdeuxR '
Le résultat est que l'hydrogène est "ancré" aux carbones rompant une liaison, et ainsi de suite jusqu'à produire l'alcane correspondant, RCHdeuxCHdeuxR '. Cela sature non seulement l'hydrocarbure initial, mais modifie également sa structure moléculaire..
Ajout d'halogénures d'hydrogène
Ici, la molécule inorganique HX est ajoutée, où X peut être l'un des halogènes (F, Cl, Br ou I):
RC≡CR '+ HX => RCH = CXR'
L'hydratation
L'hydratation des alcynes se fait lorsqu'ils ajoutent une molécule d'eau pour former un aldéhyde ou une cétone:
RC≡CR '+ HdeuxO => RCHdeuxCOR '
Si R 'est un H, c'est un aldéhyde; s'il s'agit d'un alkyle, alors c'est une cétone. Dans la réaction, un composé connu sous le nom d'énol (RCH = C (OH) R ') est formé comme intermédiaire..
Celui-ci subit une conversion de la forme énol (C-OH) à la forme cétonique (C = O) dans un équilibre appelé tautomérisation.
Ajout d'halogènes
Et en ce qui concerne les ajouts, les molécules diatomiques des halogènes (Xdeux= Fdeux, Cldeux, Brdeux J'ai entendudeux):
RC≡CR '+ 2Xdeux => RCXdeux-CXdeuxR '
Alkylation d'acétylène
D'autres alcynes peuvent être préparés à partir de la solution d'acétylure de sodium en utilisant un halogénure d'alkyle:
HC≡CNa + RX => HC≡CR + NaX
Par exemple, s'il s'agissait d'iodure de méthyle, l'alcyne résultant serait:
HC≡CNa + CH3I => HC≡CCH3 + NaX
HC≡CCH3 est la pointe, également connue sous le nom de méthyleacétylène.
Structure chimique
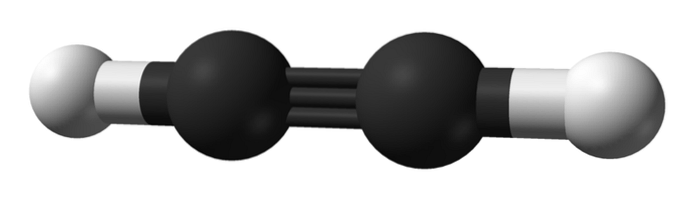
Quelle est la structure des alcynes? Une molécule d'acétylène est montrée dans l'image du haut. À partir de là, la géométrie linéaire de la liaison C enlaceC peut être clairement observée.
Par conséquent, là où il y a une triple liaison, la structure de la molécule doit être linéaire. C'est une autre des différences notables entre eux et le reste des hydrocarbures.
Les alcanes sont généralement représentés sous forme de zigzags, car ils ont une hybridation sp3 et leurs liens sont distants de 109 °. Ils sont en fait une chaîne de tétraèdres liés de manière covalente. Alors que les alcènes sont plats par hybridation spdeux de ses carbones, formant plus précisément un plan trigonal avec des liaisons séparées par 120 °.
Dans les alcynes, l'hybridation orbitale est sp, c'est-à-dire qu'ils ont 50% de caractère s et 50% de caractère p. Il existe deux orbitales hybrides sp qui se lient à des atomes H dans l'acétylène ou à des groupes alkyle dans les alcynes..
La distance entre les deux H ou R est de 180 °, en plus du fait que ce n'est qu'ainsi que les orbitales p pures des carbones peuvent former la triple liaison. Pour cette raison, la liaison -C≡C- est linéaire. En regardant la structure de n'importe quelle molécule, le -C≡C- se distingue dans les régions où le squelette est très linéaire.
Distance des liaisons et alcynes terminaux
Les carbones dans la triple liaison sont plus proches les uns que dans la double ou simple liaison. En d'autres termes, C≡C est plus courte que C = C et C-C. En conséquence, la liaison est plus forte car les deux liaisons π aident à stabiliser la liaison σ simple..
Si la triple liaison est à la fin d'une chaîne, alors c'est un alcyne terminal. Par conséquent, la formule dudit composé doit être HC≡CR, où H met en évidence la fin ou le début de la chaîne.
Si au contraire il s'agit d'une triple liaison interne, la formule est RC≡CR ', où R et R' sont les côtés droit et gauche de la chaîne.
Nomenclature
Comment les alcynes sont-ils nommés selon les règles dictées par l'IUPAC? De la même manière que les alcanes et les alcènes ont été nommés. Pour ce faire, le suffixe -ano ou -eno est remplacé par le suffixe -ino.
Par exemple: le HC≡CCH3 il s'appelle propyne, car il a trois carbones, comme le propane (CH3CHdeuxCH3). Le HC≡CCHdeuxCH3 est le 1-butyne, qui est un alcyne terminal. Mais dans le cas du CH3C≡CCH3 c'est du 2-butyne, et en cela la triple liaison n'est pas terminale mais interne.
Le CH3C≡CCHdeuxCHdeux(CH3)deux est la 5-méthyl-2-hexyne. Les carbones sont comptés du côté le plus proche de la triple liaison.
Un autre type d'alcynes sont les cycloalcines. Pour eux, il suffit de remplacer le suffixe -ano par -ino du cycloalcane correspondant. Ainsi, le cyclopropane qui a une triple liaison est appelé cyclopropino (qui n'existe pas).
Lorsqu'il y a deux triples liaisons, le préfixe di- est ajouté au nom. Des exemples sont HC≡C-C≡H, le diacétylène ou le propadino; et à HC≡C-C-C≡H, butadiino.
Applications
Acétylène ou éthyne
Le plus petit des alcynes épaissit le nombre possible d'utilisations de ces hydrocarbures. À partir de là, grâce à des alkylations, d'autres composés organiques peuvent être synthétisés. De même, il subit des réactions d'oxydation pour obtenir de l'éthanol, de l'acide acétique, de l'acide acrylique, entre autres..
Une autre de ses utilisations consiste à fournir la source de chaleur pour exciter les électrons des atomes; plus spécifiquement des cations métalliques dans les déterminations d'absorption-émission atomique, une technique spectroscopique largement utilisée.
Alcynes naturelles
Les seules méthodes existantes pour préparer les alcynes ne sont pas seulement synthétiques ou avec application de chaleur en l'absence d'oxygène, mais aussi biologiques.
Ceux-ci utilisent des enzymes appelées acétylénases, qui peut déshydrogéner une double liaison. Grâce à cela, de nombreuses sources naturelles d'alcynes sont obtenues.
En conséquence, des poisons, des antidotes, des médicaments ou tout autre composé offrant un certain bénéfice peuvent être extraits de ces sources; surtout quand il s'agit de santé. Les alternatives sont nombreuses lorsqu'il s'agit de modifier leurs structures d'origine et de les avoir comme support pour de nouveaux alcynes..
Exemples d'alcynes
Jusqu'à présent, de nombreux exemples d'alcynes ont été mentionnés. Cependant, certains proviennent de sources très spécifiques ou ont des structures moléculaires particulières: ce sont des polyacétylènes.
Cela signifie qu'il peut y avoir plus d'une triple liaison faisant partie d'une très grande structure, et pas seulement une simple chaîne carbonée..
Acide taririque

L'acide taririque provient d'une usine située au Guatemala appelée Picramnia tariri. Il est spécifiquement extrait de l'huile de ses graines.
Dans sa structure moléculaire, on peut observer une simple triple liaison qui sépare une queue apolaire d'une tête polaire; il pourrait donc être considéré comme une molécule amphipathique.
Histrionicotoxine
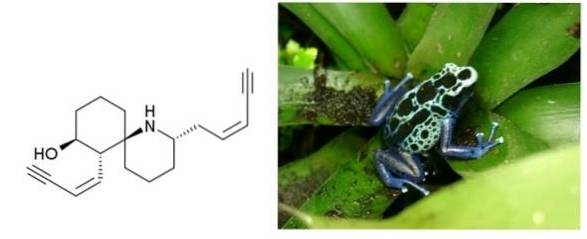
à en.wikipedia [domaine public], de Wikimedia Commons
L'histrionicotoxine est un poison sécrété par la peau des grenouilles vivant en Colombie, au Brésil et dans d'autres pays d'Amérique latine. Il a deux triples liaisons conjuguées à une double liaison. Les deux sont terminaux et séparés par un cycle à six carbones et une amine cyclique..
Cicutoxine
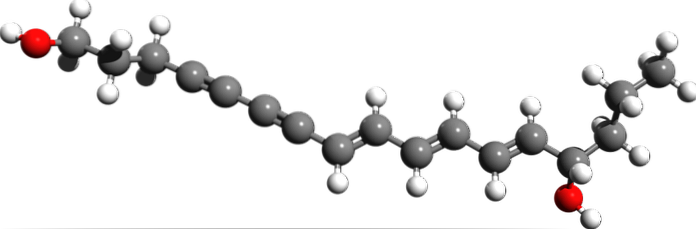
D'après la structure moléculaire de la cicutoxine, où sont les triples liaisons? Si les doubles liaisons sont plates, comme on le voit à droite, et les liaisons simples sont tétraédriques, comme aux extrémités, les triplets sont linéaires et sont sur la pente (\).
Ce composé consiste en une neurotoxine trouvée principalement dans la plante aquatique de la pruche..
Capillina
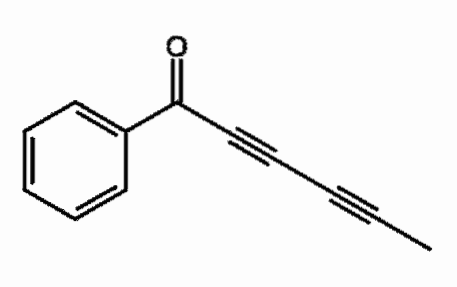
C'est un alcyne présent dans l'huile essentielle de plantes d'armoise qui est utilisé comme agent antifongique. Deux triples liaisons consécutives peuvent être observées, plus correctement conjuguées.
Que signifie? Que les triples liaisons résonnent dans toute la chaîne carbonée et impliquent l'ouverture de la double liaison C = O vers C-O-.
Pargyline
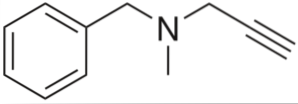
C'est un alcyne à activité antihypertensive. En analysant sa structure par parties, nous avons: un groupe benzyle à gauche, une amine tertiaire au milieu et un propynyle à droite; c'est-à-dire un groupe de propyne terminal.
Les références
- Francis A. Carey. Chimie organique. Acides carboxyliques. (sixième éd., pp. 368-397). Mc Graw Hill.
- Brennan, John. (10 mars 2018). Exemples d'alcynes. Découvrir. Tiré de: scaimer.com
- BYJU'S. (2018). Triple Bond dans Alcynes. Tiré de: byjus.com
- Encyclopédie des exemples (2017). Alcynes. Récupéré de: examples.co
- Kevin A. Boudreaux. Alcynes. Tiré de: angelo.edu
- Robert C. Neuman, Jr. Alkenes et Alkynes. [PDF]. Tiré de: chem.ucr.edu



Personne n'a encore commenté ce post.