
Allotropes de carbone carbone amorphe, graphite, graphènes, nanotubes

Les allotropes de carbone ce sont les différentes formes physiques sous lesquelles leurs atomes peuvent être arrangés et liés. Chacun correspond à un solide avec ses propres caractéristiques particulières. Moléculairement et structurellement, ils se distinguent les uns des autres. Il existe deux types principaux de ces allotropes: cristallins et amorphes..
Les allotropes cristallins sont ceux qui ont un motif répétitif de leurs atomes dans l'espace. Pendant ce temps, dans les allotropes amorphes, les atomes sont disposés en désordre, sans qu'il y ait deux régions identiques dans le solide. Donc, les premiers sont commandés, et les seconds, en désordre.
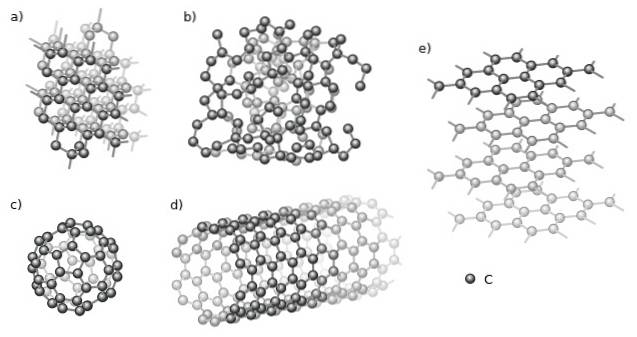
(https://creativecommons.org/licenses/by-sa/4.0)]
Parmi les cristallins, on trouve le diamant (a) et le graphite (e) par excellence. On observe sur l'image du haut différentes structures qui ont un aspect commun: elles ne sont composées que d'atomes de carbone (sphères noires).
Et parmi les allotropes amorphes, nous avons le carbone amorphe (b), dont, comme on peut le voir, sa structure est désordonnée. Cependant, il existe de nombreux types de carbones amorphes, c'est donc une famille de solides..
En outre, les atomes de carbone peuvent former des supramolécules, telles que les fullerènes (c) et les nanotubes (d). Ces supramolécules peuvent varier en taille et en forme, mais elles conservent les mêmes géométries; sphérique et tubulaire pour les fullerènes et les nanotubes, respectivement.
Index des articles
- 1 Liaisons covalentes de carbone
- 1.1 Hexagones
- 1.2 Tétraèdres
- 2 Carbone amorphe
- 2.1 Politisme
- 2.2 Groupes fonctionnels
- 3 Graphite
- 3.1 Propriétés physiques
- 4 graphènes
- 5 nanotubes de carbone
- 5.1 Conformations structurelles
- 6 fullerènes
- 7 Références
Liaisons covalentes de carbone
Avant d'aborder certains des allotropes connus du carbone, il est nécessaire d'examiner comment les atomes de carbone se lient..
Selon la théorie des liaisons de valence, le carbone a quatre électrons dans sa couche de valence, avec lesquels ils forment des liaisons covalentes. Grâce à la promotion électronique et à l'hybridation, les quatre électrons peuvent être placés dans quatre orbitales distinctes, qu'elles soient pures ou hybrides.
Par conséquent, le carbone a la capacité de former jusqu'à un maximum de quatre liaisons.
DC. En ayant quatre liaisons C-C, les atomes atteignent l'octet de valence, et ils deviennent très stables. Cependant, cela ne signifie pas qu'il ne peut y avoir que trois de ces liens, tels que ceux vus dans les hexagones..
Hexagones
Selon les hybridations de l'atome de carbone, des doubles ou triples liaisons peuvent être trouvées dans la structure de leurs allotropes respectifs. Mais, encore plus évidente que l'existence de telles liaisons, est la géométrie que les carbones adoptent.
Par exemple, si un hexagone est observé, cela signifie que les carbones ont une hybridation spdeux et donc avoir une orbitale p pur avec un électron solitaire. Pouvez-vous voir des hexagones parfaits dans la première image? Ces allotropes qui les contiennent impliquent que leurs carbones sont spdeux, s'il y a ou non des doubles liaisons (telles que celles du cycle benzénique).
Une couche maillée, plane ou hexagonale est alors constituée de sp carbonesdeux qui a un "plafond" ou "nuage" électronique, produit de l'électron non apparié de l'orbitale p. Cet électron peut former des liaisons covalentes avec d'autres molécules, ou attirer les charges positives d'ions métalliques; comme le K+ et Na+.
De même, ces électrons permettent à ces coques de s'empiler les unes sur les autres, sans collage (en raison d'un obstacle géométrique et spatial au chevauchement des deux orbitales p). Cela signifie que les allotropes avec des géométries hexagonales peuvent ou non être ordonnés pour construire un cristal..
Tétraèdres
Si un tétraèdre est observé, comme cela sera expliqué dans la dernière section, cela signifie que les carbones ont une hybridation sp3. En eux, il y a quatre liaisons simples C-C, et ils forment un réseau cristallin tétraédrique. Dans de tels tétraèdres, il n'y a pas d'électrons libres comme il y en a dans les hexagones..
Carbone amorphe

Le carbone amorphe peut être imaginé comme une sorte d'éponge poreuse, avec de nombreux réseaux hexagonaux et tétraédriques arbitrairement disposés. Dans cette matrice minérale, ils peuvent piéger d'autres éléments, qui peuvent compacter ou dilater ladite éponge; et de la même manière, ses noyaux structurels peuvent être plus grands ou plus petits.
Ainsi, en fonction du% de carbone, divers types de carbones amorphes sont dérivés; comme la suie, le charbon de bois, l'anthracite, le noir de carbone, la tourbe, le coke et le charbon actif.
À première vue, ils se ressemblent tous à distance (image du haut), avec des dégradés jusqu'aux bords des tons noirs, ternes ou métalliques et grisâtres..
Tous les carbones amorphes n'ont pas la même origine. Le carbone végétal, comme son nom l'indique, est le produit de la combustion de masses végétales et de bois. Alors que le noir de carbone et le coke sont des produits de différentes étapes et conditions des processus pétroliers..
Bien qu'ils ne semblent pas très attractifs et que l'on puisse croire qu'ils ne servent que de carburants, les porosités de leurs solides attirent l'attention dans les applications technologiques d'épuration, telles que le stockage d'absorbants et de substances, ainsi que comme supports catalytiques..
Politypisme
Les structures des carbones amorphes sont complexes et désordonnées; mais des études cristallographiques ont montré qu'en réalité ce sont des polytypes tétraédriques (diamant) et hexagonaux (graphite), disposés arbitrairement en couches.
Par exemple, si T et H sont les couches tétraédrique et hexagonale, respectivement, alors un carbone amorphe peut être structurellement décrit comme: THTHHTH; ou HTHTTHTHHHT, etc. Certaines séquences de couches T et H définissent un type de carbone amorphe; mais en eux, il n'y a pas de tendance ou de modèle répétitif.
C'est pour cette raison qu'il est structurellement difficile de caractériser ces allotropes de carbone; et au lieu de cela, son% de carbone est préféré, ce qui est une variable qui facilite ses différences, en plus de ses propriétés physiques et de sa tendance à brûler ou brûler.
Groupes fonctionnels
Il a été mentionné que les plans hexagonaux ont un électron non apparié avec lequel il peut former une liaison avec d'autres molécules ou atomes. Si, pour dire, les molécules environnantes sont les HdeuxO et COdeux, On peut s'attendre à ce que des groupes OH et COOH se forment, respectivement. Ils peuvent également se lier à des atomes d'hydrogène, formant des liaisons C-H..
Les possibilités sont très variées, mais en résumé les carbones amorphes peuvent héberger des groupes fonctionnels oxygénés. Lorsque ces hétéroatomes sont présents, ils ne sont pas seulement situés sur les bords des plans, mais aussi et même à l'intérieur.
Graphite

L'image ci-dessus montre un modèle avec des sphères et des chaînes de la structure cristalline du graphite. Heureusement, les ombres des sphères aident à visualiser les nuages π suite à la délocalisation de leurs électrons non appariés. Cela a été mentionné dans la première section, sans autant de détails.
Ces nuages π peuvent être comparés à deux systèmes: celui des anneaux benzéniques, et celui des «mers d'électrons» dans les cristaux métalliques..
Orbitales p ils se rejoignent pour construire une piste où les électrons voyagent librement; mais, seulement entre deux couches hexagonales; perpendiculairement à eux, il n'y a pas de flux d'électrons ou de courant (les électrons devraient passer à travers les atomes de carbone).
Comme il y a une migration constante des électrons, des dipôles instantanés se forment constamment, qui induisent d'autres dipôles d'atomes de carbone qui sont au-dessus ou au-dessous; c'est-à-dire que les couches ou feuilles de graphite restent ensemble grâce aux forces de dispersion de Londres..
Ces couches hexagonales, comme on peut s'y attendre, créent un cristal de graphite hexagonal; ou plutôt, une série de petits cristaux reliés à des angles différents. Les nuages π se comportent comme s'ils étaient un "beurre électrique", permettant aux couches de glisser avant toute perturbation extérieure sur les cristaux.
Propriétés physiques
Les propriétés physiques du graphite sont faciles à comprendre une fois que sa structure moléculaire a été abordée..
Par exemple, le point de fusion du graphite est très élevé (supérieur à 4400 ° C), car l'énergie fournie sous forme de chaleur doit séparer de manière irréversible les couches hexagonales, et aussi casser leurs hexagones..
On vient de dire que leurs couches peuvent glisser les unes sur les autres; Et pas seulement, mais ils peuvent également se retrouver sur d'autres surfaces, comme la cellulose qui compose le papier lorsqu'il est déposé à partir du graphite des crayons. Cette propriété permet au graphite d'agir comme un excellent lubrifiant..
Et, déjà mentionné, c'est un bon conducteur d'électricité, mais aussi de chaleur et de son..
Graphènes

Bien qu'il n'ait pas été montré dans la première image, cet allotrope de carbone ne peut pas être laissé de côté. Supposons que les couches de graphite soient saisies et condensées en une seule feuille, ouverte et couvrant une grande surface. Si cela était fait de manière moléculaire, les graphènes naîtraient (image du haut).
Ainsi, les graphènes sont une feuille graphitique individuelle, qui n'interagit pas avec les autres et peut onduler comme un drapeau. Notez qu'il ressemble aux murs des nids d'abeilles des abeilles.
Ces feuilles de graphène préservent et multiplient les propriétés du graphite. Ses hexagones sont très difficiles à séparer, c'est pourquoi ils présentent une résistance mécanique abyssale; encore plus haut que l'acier. De plus, ils sont extrêmement légers et minces, et théoriquement un gramme suffirait à couvrir tout un terrain de football..
Si vous regardez à nouveau l'image du haut, vous pouvez voir qu'il n'y a pas de doubles liaisons. Certes, il peut y en avoir, ainsi que des triples liaisons (graffins). C'est ici que la chimie du graphène s'ouvre, disons.
Comme le graphite et les autres couches hexagonales, d'autres molécules peuvent se lier de manière covalente à la surface du graphène, fonctionnalisant sa structure pour des applications électroniques et biologiques..
Nanotubes de carbone
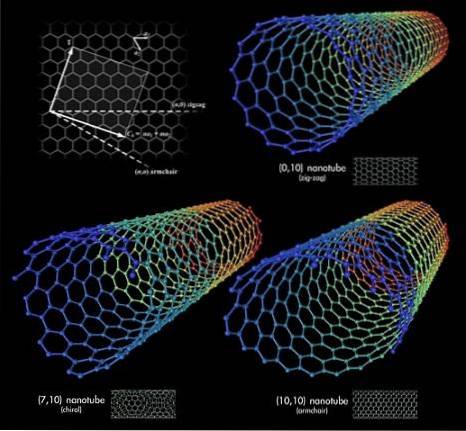
Supposons maintenant que nous ayons saisi les feuilles de graphène et que nous commencions à les rouler dans un tube; Ce sont les nanotubes de carbone. Les longueurs et les rayons de ces tubes sont variables, tout comme leurs conformations spatiales. Avec le graphène et les fullerènes, ces nanotubes constituent la triade des allotropes de carbone les plus surprenants.
Conformations structurelles
Trois nanotubes de carbone sont représentés sur l'image du haut. Quelle est la différence entre eux? Tous les trois ont des murs à motifs hexagonaux et présentent les mêmes propriétés de surface déjà décrites. La réponse réside alors dans les orientations relatives de ces hexagones.
La première conformation correspond au type zigzag (coin supérieur droit). Si vous regardez attentivement, vous verrez qu'il comporte des rangées d'hexagones parfaitement perpendiculaires à l'axe longitudinal du tube..
En revanche, pour la conformation de type fauteuil, ou chaise (coin inférieur droit), les hexagones sont disposés en rangées dans le même sens que l'axe longitudinal du tube. Dans le premier nanotube, les hexagones traversent la surface dans le sens de son diamètre, et dans le second nanotube, ils courent le long de la surface, de «bout en bout».
Et enfin, il y a le nanotube chiral (coin inférieur gauche). Comparez un escalier en colimaçon allant à gauche ou à droite. La même chose arrive à ce nanotube de carbone: ses hexagones sont disposés de manière ascendante à gauche ou à droite. Comme il existe deux versions spatiales, on dit alors qu'il présente de la chiralité.
Fullerènes
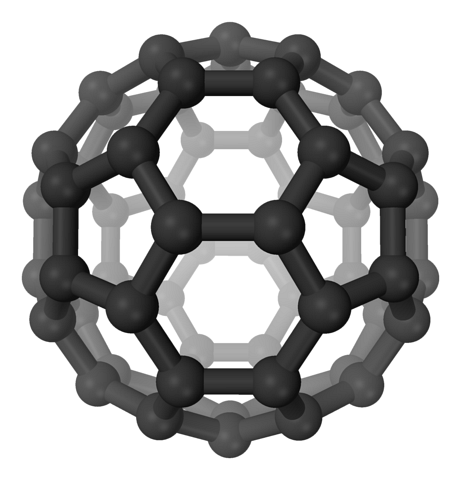
Dans les fullerènes, les hexagones sont toujours maintenus, mais en plus, les pentagones apparaissent, tous avec des carbones spdeux. Les feuilles ou couches sont déjà laissées pour compte: elles ont maintenant été pliées de manière à former un ballon, semblable à un ballon de football; et selon le nombre de carbones, à un ballon de rugby.
Les fullerènes sont des molécules de taille différente. Le plus célèbre est le C60 (image du haut). Ces allotropes de carbone doivent être traités comme des ballons, qui peuvent se serrer ensemble pour former des cristaux, dans lesquels des ions et d'autres molécules peuvent être piégés dans leurs interstices..
Ces billes sont des supports ou supports spéciaux pour les molécules. Comment? Par les liaisons covalentes à sa surface, en particulier, aux carbones adjacents d'un hexagone. On dit alors que le fullerène a été fonctionnalisé (un adduit exohédrique).
Ses parois peuvent être stratégiquement brisées pour stocker des molécules à l'intérieur; ressemblant à une capsule sphérique. Aussi, ces billes peuvent présenter des fissures et être fonctionnalisées en même temps; tout dépendra de l'application à laquelle ils sont destinés.
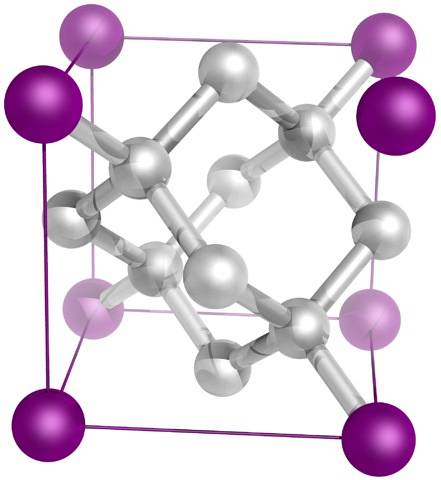
Et enfin, le plus connu de tous les allotropes de carbone: le diamant (bien que tous ne soient pas du carbone).
Structurellement, il se compose d'atomes de carbone sp3, formant quatre liaisons C-C et un réseau tridimensionnel de tétraèdres (image du haut) dont la cellule cristalline est cubique. C'est le plus dur des minéraux et son point de fusion est proche de 4000 ° C..
Ses tétraèdres sont capables de transférer efficacement la chaleur à travers le réseau cristallin; mais pas avec l'électricité, car ses électrons sont très bien situés dans ses quatre liaisons covalentes et il ne peut aller nulle part. C'est donc un bon conducteur thermique, mais c'est un isolant électrique..
Selon la façon dont il est facetté, il peut diffuser la lumière sous de nombreux angles brillants et attrayants, c'est pourquoi ils sont convoités en tant que pierres précieuses et bijoux..
Le réseau est très résistant, car il faudrait beaucoup de pression pour déplacer ses tétraèdres. Cette propriété en fait un matériau à haute résistance mécanique et dureté, capable d'effectuer des coupes précises et nettes, comme avec le scalpel à pointe diamantée..
Leurs couleurs dépendent de leurs défauts cristallographiques et de leurs impuretés.
Les références
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Méndez Medrano, Ma. Guadalupe, Rosu, H. C., Torres González, L. A. (2012). Graphène: l'allotrope de carbone le plus prometteur. Loi sur l’université. vol. 22, non. 3, avril-mai 2012, p. 20-23, Université de Guanajuato, Guanajuato, Mexique.
- IES La Magdalena. Aviles. Asturies. (s.f.). Formes allotropiques de carbone. [PDF]. Récupéré de: fisquiweb.es
- Wikipédia. (2019). Allotropes de carbone. Récupéré de: es.wikipedia.org
- Sederberg David. (s.f.). Allotropes de carbone. Récupéré de: web.ics.purdue.edu
- Sederberg, D. (2009). Allotropes de carbone: tout dépend de la façon dont vous êtes assemblé. Récupéré de: physics.purdue.edu
- Hirsh A. (2010). L'ère des allotropes de carbone. Département de chimie et de pharmacie et Centre interdisciplinaire des matériaux moléculaires (ICMM), Université Friedrich-Alexander Erlangen-Nuremberg, Henkestrasse 42, 91054 Erlangen, Allemagne.
- Le conseil d'administration du système de l'Université du Wisconsin. (2013). Nanotubes et autres formes de carbone. Récupéré de: chemistry.beloit.edu
- Clark Jim. (2012). Structures covalentes géantes. Récupéré de: chemguide.co.uk


Personne n'a encore commenté ce post.