
Propriétés des anhydrides, mode de formation et applications
Les anhydrides Ce sont des composés chimiques qui proviennent de l'union de deux molécules par la libération d'eau. Ainsi, cela pourrait être considéré comme une déshydratation des substances initiales; bien que ce ne soit pas tout à fait vrai.
En chimie organique et inorganique, on en fait mention, et dans les deux branches leur compréhension diffère à un degré appréciable. Par exemple, en chimie inorganique, les oxydes basiques et acides sont considérés comme les anhydrides de leurs hydroxydes et acides respectivement, puisque les premiers réagissent avec l'eau pour former les seconds..
Ici, une confusion peut surgir entre les termes «anhydre» et «anhydride». Généralement, anhydre fait référence à un composé auquel il a été déshydraté sans modification de sa nature chimique (il n'y a pas de réaction); tandis qu'avec un anhydride, il y a un changement chimique, reflété dans la structure moléculaire.
Si les hydroxydes et acides sont comparés à leurs oxydes (ou anhydrides) correspondants, on verra qu'il y a eu une réaction. D'autre part, certains oxydes ou sels peuvent être hydratés, perdre de l'eau et rester les mêmes composés; mais, sans eau, c'est-à-dire anhydre.
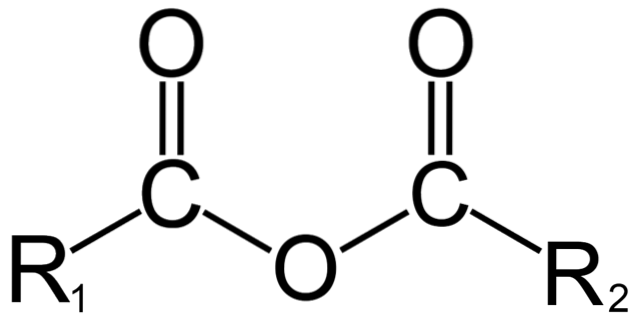
En chimie organique, par contre, ce que l'on entend par anhydride est la définition initiale. Par exemple, l'un des anhydrides les plus connus sont ceux dérivés d'acides carboxyliques (image du haut). Ceux-ci consistent en l'union de deux groupes acyle (-RCO) à travers un atome d'oxygène.
Dans sa structure générale, il est indiqué R1 pour un groupe acyle, et Rdeux pour le deuxième groupe acyle. Parce que R1 et Rdeux ils sont différents, ils proviennent d'acides carboxyliques différents et il s'agit alors d'un anhydride d'acide asymétrique. Lorsque les deux substituants R (qu'ils soient ou non aromatiques) sont identiques, dans ce cas on parle d'un anhydride d'acide symétrique.
Lorsque deux acides carboxyliques se lient pour former l'anhydride, de l'eau peut se former ou non, ainsi que d'autres composés. Tout dépendra de la structure de ces acides.
Index des articles
- 1 Propriétés des anhydrides
- 1.1 Réactions chimiques
- 2 Comment se forment les anhydrides?
- 2.1 Anhydrides cycliques
- 3 Nomenclature
- 4 applications
- 4.1 Anhydrides organiques
- 5 exemples
- 5.1 Anhydride succinique
- 5.2 Anhydride glutarique
- 6 Références
Propriétés des anhydrides
Les propriétés des anhydrides dépendront de ceux auxquels vous faites référence. Presque tous ont en commun de réagir avec l'eau. Cependant, pour les anhydrides dits basiques inorganiques, en fait plusieurs d'entre eux sont même insolubles dans l'eau (MgO), donc cette déclaration se concentrera sur les anhydrides d'acides carboxyliques.
Les points de fusion et d'ébullition tombent sur la structure moléculaire et les interactions intermoléculaires pour le (RCO)deuxOu, ceci étant la formule chimique générale de ces composés organiques.
Si la masse moléculaire de (RCO)deuxOu il est faible, probablement un liquide incolore à température et pression ambiantes. Par exemple, l'anhydride acétique (ou l'anhydride éthanoïque), (CH3CO)deuxOu bien, c'est un liquide et celui de la plus grande importance industrielle, sa production étant très vaste..
La réaction entre l'anhydride acétique et l'eau est représentée par l'équation chimique suivante:
(CH3CO)deuxO + HdeuxO => 2CH3COOH
Notez que lorsque la molécule d'eau est ajoutée, deux molécules d'acide acétique sont libérées. La réaction inverse, cependant, ne peut pas se produire pour l'acide acétique:
2CH3COOH => (CH3CO)deuxO + HdeuxO (ne se produit pas)
Il est nécessaire de recourir à une autre voie synthétique. Les acides dicarboxyliques, par contre, peuvent le faire par chauffage; mais cela sera expliqué dans la section suivante.
Réactions chimiques
Hydrolyse
L'une des réactions les plus simples des anhydrides est leur hydrolyse, qui vient d'être montrée pour l'anhydride acétique. En plus de cet exemple, il y a celui de l'anhydride d'acide sulfurique:
HdeuxSdeuxOU ALORS7 + HdeuxOU ALORS <=> 2HdeuxSW4
Ici, vous avez un anhydride d'acide inorganique. Notez que pour le HdeuxSdeuxOU ALORS7 (également appelé acide disulfurique), la réaction est réversible, donc chauffage HdeuxSW4 le concentré donne lieu à la formation de son anhydride. Si, au contraire, il s'agit d'une solution diluée de HdeuxSW4, SO est libéré3, anhydride sulfurique.
Estérification
Les anhydrides d'acide réagissent avec les alcools, avec la pyridine entre les deux, pour donner un ester et un acide carboxylique. Par exemple, considérons la réaction entre l'anhydride acétique et l'éthanol:
(CH3CO)deuxO + CH3CHdeuxOH => CH3COdeuxCHdeuxCH3 + CH3COOH
Formant ainsi l'ester éthyl éthanoate, CH3COdeuxCHdeuxCH3, et acide éthanoïque (acide acétique).
Pratiquement, ce qui se passe est la substitution de l'hydrogène du groupe hydroxyle, par un groupe acyle:
R1-OH => R1-OCORdeux
Dans le cas de (CH3CO)deuxOu, son groupe acyle est -COCH3. Par conséquent, on dit que le groupe OH subit une acylation. Cependant, l'acylation et l'estérification ne sont pas des concepts interchangeables; l'acylation peut se produire directement sur un cycle aromatique, connue sous le nom d'acylation de Friedel-Crafts.
Ainsi, les alcools en présence d'anhydrides d'acide sont estérifiés par acylation.
Par contre, un seul des deux groupes acyle réagit avec l'alcool, l'autre reste avec l'hydrogène, formant un acide carboxylique; que pour le cas de (CH3CO)deuxOu, est l'acide éthanoïque.
Amidation
Les anhydrides d'acide réagissent avec l'ammoniac ou les amines (primaires et secondaires) pour donner naissance à des amides. La réaction est très similaire à l'estérification qui vient d'être décrite, mais le ROH est remplacé par une amine; par exemple, une amine secondaire, RdeuxNH.
Encore une fois, la réaction entre (CH3CO)deuxO et diéthylamine, EtdeuxNH:
(CH3CO)deuxO + 2EtdeuxNH => CH3CONETdeux + CH3ROUCOULER- +NHdeuxEtdeux
Et diéthylacétamide, CH3CONETdeux, et un sel carboxylé d'ammonium, CH3ROUCOULER- +NHdeuxEtdeux.
Bien que l'équation puisse sembler un peu difficile à comprendre, regardez simplement comment le groupe -COCH3 remplacer le H d'un EtdeuxNH pour former l'amide:
EtdeuxNH => EtdeuxNCOCH3
Plutôt qu'une amidation, la réaction est toujours une acylation. Tout se résume dans ce mot; cette fois, l'amine subit une acylation et non l'alcool.
Comment se forment les anhydrides?
Les anhydrides inorganiques sont formés en faisant réagir l'élément avec de l'oxygène. Ainsi, si l'élément est métallique, il se forme un oxyde métallique ou un anhydride basique; et s'il est non métallique, il se forme un oxyde ou un anhydride d'acide non métallique.
Pour les anhydrides organiques, la réaction est différente. Deux acides carboxyliques ne peuvent pas se joindre directement pour libérer de l'eau et former de l'anhydride d'acide; la participation d'un composé non encore mentionné est nécessaire: chlorure d'acyle, RCOCl.
L'acide carboxylique réagit avec le chlorure d'acyle, produisant l'anhydride et le chlorure d'hydrogène respectifs:
R1COCl + RdeuxCOOH => (R1CO) OU (CORdeux) + HCl
CH3COCl + CH3COOH => (CH3CO)deuxO + HCl
UN CH3 provient du groupe acétyle, CH3CO-, et l'autre est déjà présent dans l'acide acétique. Le choix d'un chlorure d'acyle spécifique, ainsi que de l'acide carboxylique, peut conduire à la synthèse d'un anhydride d'acide symétrique ou asymétrique.
Anhydrides cycliques
Contrairement aux autres acides carboxyliques qui nécessitent un chlorure d'acyle, les acides dicarboxyliques peuvent se condenser en leur anhydride correspondant. Pour cela, il est nécessaire de les chauffer pour favoriser la libération de HdeuxO. Par exemple, la formation d'anhydride phtalique à partir d'acide phtalique est montrée.

Notez comment l'anneau pentagonal est terminé, et l'oxygène qui joint les deux groupes C = O en fait partie; c'est un anhydride cyclique. De même, on peut apprécier que l'anhydride phtalique est un anhydride symétrique, car à la fois R1 comme Rdeux sont identiques: un anneau aromatique.
Tous les acides dicarboxyliques ne sont pas capables de former leur anhydride, car lorsque leurs groupes COOH sont largement séparés, ils sont forcés de compléter des cycles de plus en plus grands. Le plus grand anneau qui peut être formé est un anneau hexagonal, plus grand que cela la réaction n'a pas lieu.
Nomenclature
Comment les anhydrides sont-ils nommés? En laissant de côté les inorganiques, pertinents pour les problèmes d'oxyde, les noms des anhydrides organiques expliqués jusqu'à présent dépendent de l'identité de R1 et Rdeux; c'est-à-dire de ses groupes acyle.
Si les deux R sont identiques, remplacez simplement le mot «acide» par «anhydride» dans le nom respectif de l'acide carboxylique. Et si, au contraire, les deux R sont différents, ils sont nommés par ordre alphabétique. Par conséquent, pour savoir comment l'appeler, vous devez d'abord voir s'il s'agit d'un anhydride d'acide symétrique ou asymétrique..
Le CH3CO)deuxO est symétrique, puisque R1= Rdeux = CH3. Il dérive de l'acide acétique ou éthanoïque, son nom est donc, suivant l'explication précédente: anhydride acétique ou éthanoïque. La même chose se produit avec l'anhydride phtalique que nous venons de mentionner.
Supposons que nous ayons l'anhydride suivant:
CH3CO (O) COCHdeuxCHdeuxCHdeuxCHdeuxCHdeuxCH3
Le groupe acétyle à gauche provient de l'acide acétique et celui de droite provient de l'acide heptanoïque. Pour nommer cet anhydride, vous devez nommer ses groupes R par ordre alphabétique. Donc, son nom est: anhydride acétique heptanoïque.
Applications
Les anhydrides inorganiques ont des applications infinies, de la synthèse et de la formulation de matériaux, céramiques, catalyseurs, ciments, électrodes, engrais, etc., à comme revêtement de la croûte terrestre avec ses milliers de minéraux de fer et d'aluminium, et le dioxyde de carbone exhalé par les organismes vivants.
Ils représentent la source de départ, le point où de nombreux composés utilisés dans les synthèses inorganiques sont dérivés. L'un des anhydrides les plus importants est le dioxyde de carbone, COdeux. Il est, avec l'eau, essentiel à la photosynthèse. Et au niveau industriel, le SO3 Il est essentiel car à partir de celui-ci on obtient l'acide sulfurique défendeur.
Peut-être que l'anhydride avec le plus d'applications et pour avoir (tant qu'il y a de la vie) est celui de l'acide phosphorique: l'adénosine triphosphate, mieux connue sous le nom d'ATP, présente dans l'ADN et la «monnaie énergétique» du métabolisme..
Anhydrides organiques
Les anhydrides d'acide réagissent par acylation, soit à un alcool, formant un ester, une amine, donnant naissance à un amide, ou un cycle aromatique.
Il existe des millions de chacun de ces composés et des centaines de milliers d'options d'acide carboxylique pour fabriquer un anhydride; par conséquent, les possibilités synthétiques se développent considérablement.
Ainsi, l'une des applications principales est d'incorporer un groupe acyle dans un composé, en substituant l'un des atomes ou groupes de sa structure..
Chaque anhydride séparé a ses propres applications, mais en termes généraux, ils réagissent tous de la même manière. Pour cette raison, ces types de composés sont utilisés pour modifier les structures polymères, créant de nouveaux polymères; c'est-à-dire copolymères, résines, revêtements, etc..
Par exemple, l'anhydride acétique est utilisé pour acétyler tous les groupes OH dans la cellulose (image du bas). Avec cela, chaque H de l'OH est remplacé par un groupe acétyle, COCH3.
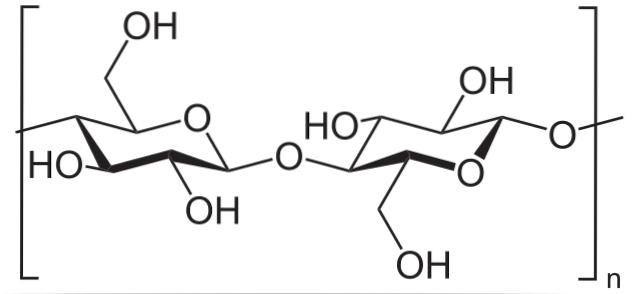
De cette manière, le polymère d'acétate de cellulose est obtenu. La même réaction peut être décrite avec d'autres structures polymères avec des groupes NHdeux, également sensible à l'acylation.
Ces réactions d'acylation sont également utiles pour la synthèse de médicaments, tels que l'aspirine (acide acétylesalicylique).
Exemples
Certains autres exemples d'anhydrides organiques se terminent. Bien qu'aucune mention n'en soit faite, les atomes d'oxygène peuvent se substituer au soufre, donnant du soufre ou même des anhydrides phosphoreux..
-C6H5CO (O) COC6H5: anhydride benzoïque. Groupe C6H5 représente un cycle benzénique. Son hydrolyse produit deux acides benzoïques.
-HCO (O) COH: anhydride formique. Son hydrolyse produit deux acides formiques.
- C6H5CO (O) COCHdeuxCH3: anhydride benzoïque propanoïque. Son hydrolyse produit des acides benzoïque et propanoïque.
-C6HOnzeCO (O) COC6HOnze: anhydride cyclohexanecarboxylique. Contrairement aux cycles aromatiques, ceux-ci sont saturés, sans doubles liaisons.
-CH3CHdeuxCHdeuxCO (O) COCHdeuxCH3: anhydride butanoïque propanoïque.
Anhydride succinique

Ici, vous avez un autre cyclique, dérivé de l'acide succinique, un acide dicarboxylique. Notez comment les trois atomes d'oxygène révèlent la nature chimique de ce type de composé.
L'anhydride maléique est très similaire à l'anhydride succinique, à la différence qu'il existe une double liaison entre les carbones qui forment la base du pentagone..
Anhydride glutarique
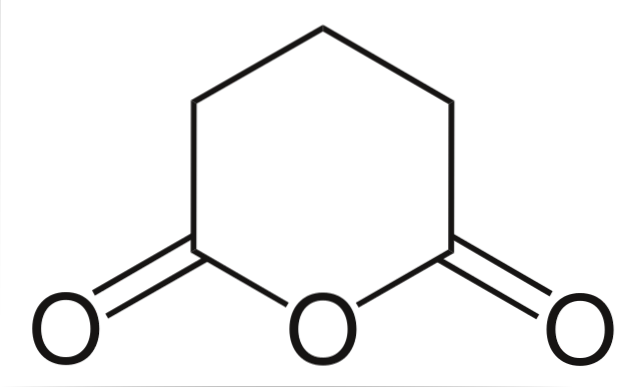
Et enfin, l'anhydride d'acide glutarique est montré. Cela se distingue structurellement de tous les autres en se composant d'un anneau hexagonal. Encore une fois, les trois atomes d'oxygène se démarquent dans la structure.
D'autres anhydrides, plus complexes, peuvent toujours être mis en évidence par les trois atomes d'oxygène très proches les uns des autres.
Les références
- Les rédacteurs de l'Encyclopaedia Britannica. (2019). Anhydride. Enclyclopaedia Britannica. Récupéré de: britannica.com
- Helmenstine, Anne Marie, Ph.D. (08 janvier 2019). Définition de l'anhydride acide en chimie. Récupéré de: thinkco.com
- Chimie LibreTexts. (s.f.). Anhydrides. Récupéré de: chem.libretexts.org
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (dixe édition.). Wiley plus.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE.
- Morrison et Boyd. (1987). Chimie organique. (Cinquième édition). Addison-Wesley Iberoamericana.
- Wikipédia. (2019). Anhydride d'acide organique. Récupéré de: en.wikipedia.org



Personne n'a encore commenté ce post.