
Formation, caractéristiques et types d'anions
UNE anion Il s'agit de toute espèce chimique à charge négative, en plus d'être l'un des deux types d'ions existants. Sa charge négative provient du fait qu'elle a un excès d'électrons par rapport à la forme neutre de l'espèce; pour chaque électron supplémentaire, sa charge négative augmente d'une unité.
La charge négative peut être localisée dans un ou plusieurs atomes, ainsi que son influence sur une molécule dans son ensemble. Par souci de simplicité, quel que soit l'endroit où se trouve la charge (-), toute l'espèce, le composé ou la molécule est considéré comme un anion..
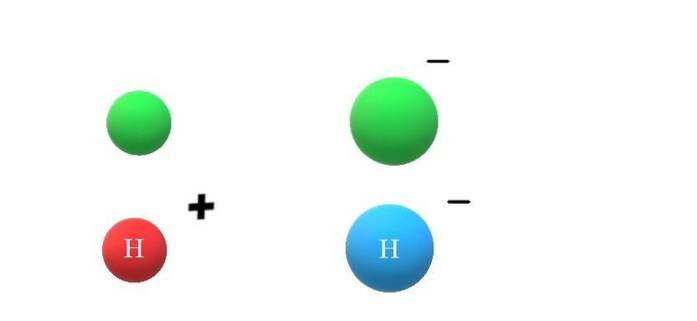
Si une espèce neutre X gagne un électron, les charges négatives en excès se manifestent par la formation de l'anion X-, ce qui entraînera également une augmentation de son rayon atomique (image du haut, avec des sphères vertes). X et X- diffèrent énormément dans leurs propriétés et dans la manière dont ils interagissent avec leur environnement.
Si X est maintenant supposé être l'atome H, par exemple, un cation ou un anion peut en découler: H+ ou H-, respectivement. Le cation H+ C'est l'ion hydrogène, également appelé proton; et le H- est l'anion hydrure, le "plus simple" de tous les anions connus.
Index des articles
- 1 Formation d'un anion
- 1.1 Frais formels et moins de liens
- 1.2 Réductions
- 1.3 Physique
- 2 caractéristiques
- 3 types
- 3.1 Monatomique
- 3.2 Oxoanions
- 3.3 Biologique
- 3.4 Polyatomique
- 3.5 Moléculaire ou complexe
- 4 Références
Formation d'un anion
La formation d'un anion peut facilement être expliquée dans la théorie; Bien que, expérimentalement, cela puisse être un défi, surtout si vous le voulez pur, sans charges positives attirées par ses charges négatives..
Frais formels et moins de liens
Un anion se forme lorsqu'il y a un excès ou un gain d'électrons dans un atome. Ledit gain peut être déterminé en utilisant les charges formelles dans une structure de Lewis. De plus, en utilisant la méthode précédente, vous pouvez savoir exactement de quel atome ou groupe d'entre eux provient la charge négative..
Lorsque les atomes forment des liaisons covalentes, même si la distribution des électrons est équitable, il peut y avoir une perte partielle d'électrons. En ce sens, moins il y a de liaisons, plus il y a d'atomes électronégatifs, plus ils auront de paires d'électrons libres et donc présenteront des charges négatives..
Considérons par exemple la molécule d'ammoniaque, NH3. NH3 il est neutre et n'a donc pas de charges électriques. Si un H était éliminé, c'est-à-dire qu'une liaison N-H était rompue, l'anion NH serait obtenudeux-. En dessinant sa structure de Lewis et en calculant la charge formelle de N, cela peut être vérifié.
Suite à la rupture de plusieurs liaisons N-H, nous avons maintenant l'anion NHdeux-; et en éliminant le dernier H, l'anion N est finalement obtenu3-, appelé anion nitrure. L'azote n'a plus le moyen de gagner plus d'électrons, et sa charge -3 est la plus négative qu'il puisse atteindre; leurs orbitales ne donnent pas plus.
Réductions
Un anion peut se former à la suite d'une réduction: il gagne des électrons en oxydant une autre espèce, qui les perd. L'oxygène, par exemple, représente très bien ce type de réaction chimique..
Lorsque l'oxygène est réduit, il s'oxyde en une autre espèce et devient l'anion oxyde, Odeux-; présent dans d'innombrables minéraux et composés inorganiques.
Physique
Un atome peut gagner des électrons s'il est en phase gazeuse:
X (g) + e- => X-(g)
Cette façon de former un anion implique une large connaissance des techniques physiques, alors que les anions gazeux ne sont pas faciles à étudier, et toutes les espèces ne sont pas non plus facilement volatilisées ou atomisées en phase gazeuse..
Caractéristiques
En termes généraux, les caractéristiques typiques d'un anion seront mentionnées ci-dessous avant de discuter de leurs types et exemples:
-Il est plus volumineux que l'atome neutre dont il est dérivé.
-Il peut être plus ou moins stable, malgré la répulsion électronique croissante entre ses propres électrons.
-Si l'anion provient d'un atome faiblement électronégatif, tel que le carbone, il est très réactif.
-Établir des moments dipolaires forts.
-Augmente encore son interaction avec les solvants polaires.
-L'anion monatomique est isoélectronique au gaz rare de son époque; c'est-à-dire qu'il a le même nombre d'électrons dans sa couche de valence.
-Il peut polariser le nuage d'électrons d'un atome voisin, repoussant ses électrons extérieurs.
Les types
Monatomique
Comme son nom l'indique, c'est un anion constitué d'un seul atome: la charge négative est bien localisée. Chaque groupe du tableau périodique a des charges négatives caractéristiques; et comme ce sont des anions, ce sont les non-métaux situés dans le bloc p. Quelques exemples et leurs noms sont ci-dessous:
-Cl-, chlorure.
-je-, Je dure.
-F-, fluorure.
-Br-, bromure.
-OU ALORSdeux-, oxyde.
-Sdeux-, sulfure.
-je connaisdeux-, séléniure.
-Thédeux-, telluride.
-Podeux-, poloniur.
-N3-, nitrure.
-P3-, phosphure.
-As3-, arséniure.
-Sb3-, antimoniuro.
-C4-, carbure.
-Oui4-, siliciure.
-B3-, Boruro.
Oxoanions
Les oxoanions sont caractérisés en ce qu'ils ont une liaison X = O, où X peut être n'importe quel élément non métallique (sauf le fluor), ou un métal (chrome, manganèse, etc.). Ils peuvent également avoir un ou plusieurs liens simples X-O.
Certains oxoanions avec leurs noms respectifs sont:
-ClO-, hypochlorite.
-Copain-, hypobromite.
-IO-, hypoiodite.
-ClOdeux-, chlorite.
-ClO3-, chlorate.
-IO3-, iodate.
-ClO4-, perchlorate.
-PO43-, phosphate.
-CO3deux-, carbonate.
-CrO4deux-, chromate.
-CrdeuxOU ALORS7deux-, bichromate.
-SW4deux-, sulfate.
-SdeuxOU ALORS3deux-, thiosulfate.
-NE PAS3-, nitrate.
-NE PASdeux-, nitrite.
-BO33-, borate.
-AsO43-, arséniate.
-PO33-, phosphite.
-MnO4-, permanganate.
Biologique
Les molécules organiques ont des groupes fonctionnels qui peuvent devenir chargés électriquement. Comment? Par la formation ou la rupture de liaisons covalentes, très similaire à l'exemple de la molécule NH3.
Certains anions organiques sont:
-CH3ROUCOULER-, acétate.
-HCOO-, Format.
-CdeuxOU ALORS4deux-, oxalate.
-RCOO-, carboxylate.
-CH3CONH-, amidate.
-RO-, alcoolate.
-R3C-, carbanion.
-CH3OU ALORS-, méthylate.
Polyatomique
Les oxoanions sont également des anions polyatomiques, c'est-à-dire qu'ils se composent de plus d'un atome. La même chose se produit avec les anions organiques. Cependant, les polyatomiques n'entrent dans aucune des classifications ci-dessus. Certains d'entre eux sont:
-CN-, cyanure (a une triple liaison, C≡N).
-OCN-, cyanate.
-SCN-, thiocyanate.
-NHdeux-, Amide.
-Oh-, hydroxyle, hydroxyde ou hydroxyle.
-OU ALORSdeux-, superoxyde.
-OU ALORSdeuxdeux-, peroxyde.
Moléculaire ou complexe
Dans les anions organiques, certains groupes fonctionnels chargés négativement ont été mentionnés. Ces groupes peuvent faire partie d'une grande molécule, et ainsi l'anion peut être un composé robuste entier avec de nombreuses liaisons. Le plus simple de ce type d'anions est la molécule hypothétique de Hdeux-.
Un autre exemple de ces anions sont les polysulfures, Sndeux-, qui se composent de chaînes avec plusieurs liaisons S-S. En outre, les composés de coordination des métaux chargés négativement tels que [CoCl4(NH3)deux]- et [CuCl4]deux-.
Les références
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE.
- Wikipédia. (2019). Anion. Récupéré de: es.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (21 mars 2019). Tableau des anions communs et liste des formules. Récupéré de: thinkco.com
- Fondation CK-12. (2016, 29 juin). Formation d'anions. Chimie LibreTexts. Récupéré de: chem.libretexts.org
- Francis E. (2002). Les anions. Collège communautaire de Clackamas. Récupéré de: dl.clackamas.edu
- Société américaine de physique. (3 novembre 2011). Synopsis: L'anion moléculaire le plus simple. Récupéré de: physics.aps.org



Personne n'a encore commenté ce post.