
Structure, propriétés, nomenclature, risques et utilisations de l'anisole
le anisole ou méthoxybenzène est un composé organique constitué d'un éther aromatique dont la formule chimique est C6H5LCO3. Son état physique est celui d'un liquide incolore, qui peut présenter des colorations jaunâtres. Il se reconnaît facilement à son odeur d'anis caractéristique.
Il s'agit alors d'un composé volatil et de forces de cohésion peu élevées; caractéristiques typiques des éthers légers, qui sont stockés dans de petits récipients scellés. Spécifiquement, l'anisole est le plus simple des éthers alkylaryliques; c'est-à-dire ceux avec un composant aromatique (Ar) et un autre composant alkyle (R), Ar-O-R.
Groupe C6H5- vient de désigner Ar, et -CH3 à R, ayant donc C6H5-O-CH3. Le cycle aromatique et la présence de -OCH3 En tant que groupe substituant appelé méthoxy, il confère à l'anisole une nucléophilie supérieure à celle du benzène et du nitrobenzène. Par conséquent, il sert de molécule intermédiaire pour la synthèse de composés à activité pharmacologique..
Son odeur caractéristique d'anis a été utilisée pour ajouter de l'anisole aux produits cosmétiques et d'hygiène qui exigent un parfum agréable..
Index des articles
- 1 Structure de l'anisole
- 1.1 Moment dipolaire
- 1.2 Cristaux
- 2 propriétés
- 2.1 Apparence physique
- 2.2 Odeur
- 2.3 Saveur
- 2.4 Masse moléculaire
- 2.5 Densité
- 2.6 Densité de vapeur
- 2.7 Point de fusion
- 2.8 Point d'ébullition
- 2.9 Point d'éclair
- 2.10 Température d'auto-inflammation
- 2.11 Viscosité
- 2.12 Tension superficielle
- 2.13 Indice de réfraction
- 2.14 Solubilité
- 2.15 nucléophilie
- 2.16 Réactivité
- 3 Nomenclature
- 4 risques
- 5 utilisations
- 5.1 Synthèses organiques
- 5.2 Parfums
- 6 Références
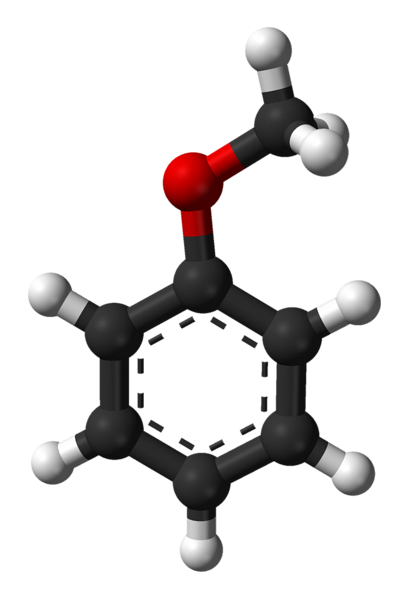
Structure anisole
L'image du haut montre la structure moléculaire de l'anisole à l'aide d'un modèle de sphères et de barres. Le cycle aromatique est apprécié, dont les carbones sont spdeux et donc il est plat, comme une feuille hexagonale; et attaché à lui est le groupe méthoxy, dont le carbone est sp3, et ses hydrogènes sont au-dessus ou au-dessous du plan de l'anneau.
L'importance du groupe -OCH3 dans la structure il va au-delà de la rupture avec la géométrie plane de la molécule: il lui confère une polarité, et par conséquent, la molécule apolaire de benzène acquiert un moment dipolaire permanent.
Moment dipolaire
Ce moment dipolaire est dû à l'atome d'oxygène, qui attire les densités d'électrons des cycles aromatique et méthyle. Grâce à cela, les molécules d'anisole peuvent interagir par des forces dipôle-dipôle; Bien qu'il n'ait aucune possibilité de former des liaisons hydrogène, car il s'agit d'un éther (ROR n'a pas H lié à l'oxygène).
Son point d'ébullition élevé (154 ° C), certifie expérimentalement les fortes interactions intermoléculaires qui régissent son liquide. De même, les forces de dispersion de Londres sont présentes, dépendant de la masse moléculaire, et des interactions π-π entre les anneaux eux-mêmes.
Cristaux
La structure de l'anisole ne lui permet cependant pas d'interagir suffisamment pour adopter un solide à température ambiante (pf = -37 ° C). Cela peut également être dû au fait que lorsque les distances intermoléculaires sont réduites, les répulsions électrostatiques entre les électrons des anneaux aromatiques voisins commencent à gagner beaucoup de force..
Par conséquent, et d'après les études cristallographiques, les molécules d'anisole dans les cristaux à une température de -173 ° C ne peuvent pas être disposées de telle sorte que leurs anneaux se font face; c'est-à-dire que leurs centres aromatiques ne sont pas alignés les uns sur les autres, mais plutôt un groupe -OCH3 est au-dessus ou au-dessous d'un anneau voisin.
Propriétés
Apparence physique
Liquide incolore mais qui peut avoir de légers tons de couleur paille.
Odeur
Odeur légèrement similaire à celle des graines d'anis.
Goût
Douce; cependant, il est modérément toxique, donc ce test est dangereux.
Masse moléculaire
108,140 g / mol.
Densité
0,995 g / mL.
Densité de vapeur
3,72 (par rapport à l'air = 1).
Point de fusion
-37 ° C.
Point d'ébullition
154 ° C.
point d'allumage
125 ° C (tasse ouverte).
La température d'auto-inflammation
475 ° C.
Viscosité
0,778 cP à 30 ° C.
Tension superficielle
34,15 dynes / cm à 30 ° C.
Indicateur de réfraction
1,5179 à 20 ° C.
Solubilité
Peu soluble dans l'eau (environ 1 mg / ml). Dans d'autres solvants, tels que l'acétone, les éthers et les alcools, il est cependant très soluble.
Nucléophilicité
L'anneau aromatique de l'anisole est riche en électrons. En effet, l'oxygène, bien qu'il soit un atome hautement électronégatif, contribue avec les électrons de son nuage π à les délocaliser à travers l'anneau dans de nombreuses structures de résonance. Par conséquent, plus d'électrons voyagent à travers le système aromatique et par conséquent, sa nucléophilie augmente..
L'augmentation de la nucléophilie a été démontrée expérimentalement en comparant sa réactivité, vis-à-vis des substitutions électrophiles aromatiques, à celle du benzène. Ainsi, l'effet remarquable du groupe -OCH est mis en évidence.3 sur les propriétés chimiques du composé.
De même, il convient de noter que les substitutions électrophiles se produisent dans les positions adjacentes (-orto) et opposées (-para) au groupe méthoxy; c'est-à-dire qu'il s'agit d'un directeur ortho-para.
Réactivité
La nucléophilie du cycle aromatique de l'anisole laisse déjà entrevoir sa réactivité. Les substitutions peuvent se produire soit dans le cycle (favorisé par sa nucléophilie), soit dans le groupe méthoxy lui-même; dans ce dernier la liaison O-CH est rompue3 pour remplacer le -CH3 par un autre groupe alkyle: O-alkylation.
Par conséquent, dans un processus d'alkylation, l'anisole peut accepter un groupe R (fragment d'une autre molécule) en substituant un H sur son cycle (C-alkylation), ou en substituant le CH3 de son groupe méthoxy. L'image suivante illustre ce qui vient d'être dit:
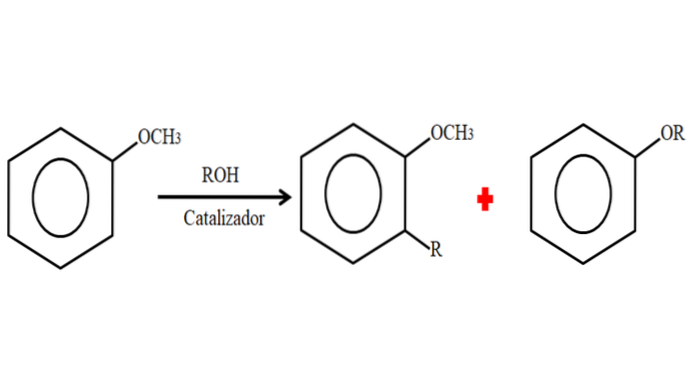
Dans l'image, le groupe R est situé en position -orto, mais il peut aussi être en position -para, à l'opposé de -OCH3. Lorsque l'O-alkylation se produit, un nouvel éther avec un autre groupe -OR est obtenu.
Nomenclature
Le nom «anisole» est le plus connu et le plus accepté, probablement dérivé de son odeur d'anis. Cependant, le nom de «méthoxybenzène» est assez spécifique, car il établit à la fois quelle est la structure et l'identité de cet éther aromatique; c'est le nom régi par la nomenclature systématique.
Un autre nom moins utilisé mais tout aussi valide est «phényl méthyl éther», qui est régi par la nomenclature traditionnelle. C'est peut-être le nom le plus spécifique de tous, car il indique directement quelles sont les deux parties structurelles de l'éther: phényl-O-méthyl, C6H5-O-CH3.
Des risques
Les études médicales n'ont pas encore été en mesure de démontrer les effets mortels possibles de l'anisole sur l'organisme à faibles doses. Cependant, comme presque tous les produits chimiques, il provoque une irritation lorsqu'il est exposé trop longtemps et à des concentrations modérées sur la peau, la gorge, les poumons et les yeux..
De plus, en raison de la nucléophilie de son anneau, une partie de celui-ci est métabolisée et donc biodégradable. En effet, du fait de cette propriété, des simulations ont montré qu'il ne peut pas se concentrer dans les écosystèmes aqueux puisque ses organismes le dégradent d'abord; et par conséquent, les rivières, les lacs ou les mers peuvent accumuler de l'anisole.
Dans les sols, compte tenu de sa volatilité, il s'évapore rapidement et est emporté par les courants d'air; étant ainsi, il n'affecte pas non plus considérablement les masses végétales ou les plantations.
En revanche, il réagit dans l'atmosphère avec les radicaux libres, et ne représente donc pas un risque de contamination de l'air que nous respirons..
Applications
Synthèses organiques
A partir de l'anisole, d'autres dérivés peuvent être obtenus par substitution électrophile aromatique. Cela permet de l'utiliser comme intermédiaire pour la synthèse de médicaments, de pesticides et de solvants auxquels on souhaite ajouter ses caractéristiques. Les voies synthétiques peuvent consister principalement en C-alkylation ou O-alkylation.
Parfums
En plus de son utilisation pour la synthèse organique, il peut être utilisé directement comme additif pour les crèmes, les pommades et les parfums, en incorporant des parfums d'anis à ces produits..
Les références
- Morrison, R. T. et Boyd, R, N. (1987). Chimie organique. 5e édition. Éditorial Addison-Wesley Interamericana.
- Carey F. A. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (10e édition.). Wiley plus.
- Centre national d'information sur la biotechnologie. (2019). Anisole. Base de données PubChem, CID = 7519. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Wikipédia. (2019). Anisole. Récupéré de: en.wikipedia.org
- Pereira, Cynthia C. M., de la Cruz, Marcus H. C., et Lachter, Elizabeth R. (2010). L'alkylation en phase liquide de l'anisole et du phénol catalysée par le phosphate de niobium. Journal de la société brésilienne de chimie, 21 (2), 367-370. dx.doi.org/10.1590/S0103-50532010000200025
- Seidel R. W. et Goddard R. (2015). Anisole à 100 K: la première détermination de la structure cristalline. Acta Crystallogr C Struct Chem, août; 71 (Pt 8): 664-6. doi: 10.1107 / S2053229615012553
- Formulation chimique. (2018). Méthoxybenzène Récupéré de: formulacionquimica.com



Personne n'a encore commenté ce post.