
Bases caractéristiques et exemples

le les bases ce sont tous ces composés chimiques qui peuvent accepter des protons ou donner des électrons. Dans la nature ou artificiellement, il existe à la fois des bases inorganiques et organiques. Par conséquent, son comportement peut être prédit pour de nombreuses molécules ioniques ou solides..
Cependant, ce qui différencie une base du reste des substances chimiques, c'est sa tendance marquée à donner des électrons par rapport, par exemple, aux espèces pauvres en densité électronique. Cela n'est possible que si la paire électronique est localisée. En conséquence, les bases ont des régions riches en électrons, δ-.

Quelles propriétés organoleptiques permettent d'identifier les bases? Ce sont généralement des substances caustiques, qui provoquent de graves brûlures par contact physique. En même temps, ils ont une touche savonneuse et dissolvent facilement les graisses. De plus, ses saveurs sont amères.
Où sont-ils dans la vie quotidienne? Les produits de nettoyage, des détergents aux savons pour les mains, constituent une source commerciale et courante de fondations. Pour cette raison, l'image de bulles en suspension dans l'air peut aider à se souvenir des bases, même si derrière elles se trouvent de nombreux phénomènes physico-chimiques impliqués..
De nombreuses bases présentent des propriétés totalement différentes. Par exemple, certains ont des odeurs nauséabondes et fortes, comme les amines organiques. D'autres, par contre, comme l'ammoniac, sont pénétrants et irritants. Ils peuvent également être des liquides incolores ou des solides blancs ioniques..
Cependant, toutes les bases ont un point commun: elles réagissent avec les acides pour produire des sels solubles dans les solvants polaires, comme l'eau..
Index des articles
- 1 Caractéristiques des bases
- 1.1 Propriétés physiques
- 1.2 Force d'une base
- 1,3 pH supérieur à 7
- 1.4 Capacité à neutraliser les acides
- 1.5 Capacité de réduction d'oxyde
- 1.6 Relâchez OH-
- 1.7 Ils ont des atomes d'azote ou des substituants qui attirent la densité électronique
- 2 Exemples de bases
- 2,1 NaOH
- 2.2 CH3OCH3
- 2.3 Hydroxydes alcalins
- 2.4 Bases organiques
- 2,5 NaHCO3
- 3 Références
Caractéristiques des bases

Hormis ce qui a déjà été mentionné, quelles caractéristiques spécifiques devraient avoir toutes les bases? Comment peuvent-ils accepter des protons ou donner des électrons? La réponse réside dans l'électronégativité des atomes de la molécule ou de l'ion; et parmi tous, l'oxygène est le plus prédominant, surtout lorsqu'il se présente sous forme d'ion hydroxyle, OH-.
Propriétés physiques
Les bases ont un goût amer et, à l'exception de l'ammoniaque, sont inodores. Sa texture est glissante et a la capacité de changer la couleur du papier de tournesol en bleu, le méthyl-orange en jaune et la phénolphtaléine en violet..
Force d'une base
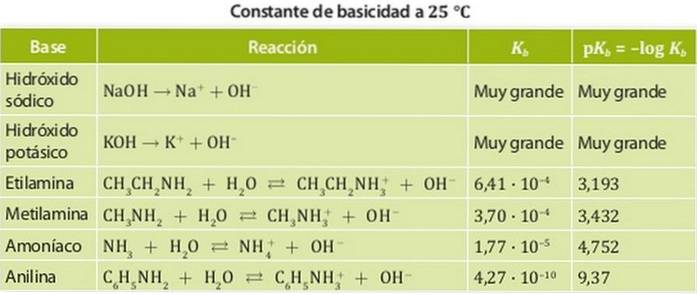
Les bases sont classées en bases fortes et en bases faibles. La force d'une base est associée à sa constante d'équilibre, donc, dans le cas des bases, ces constantes sont appelées constantes de basicité Kb.
Ainsi, les bases fortes ont une grande constante de basicité et ont donc tendance à se dissocier complètement. Des exemples de ces acides sont des alcalis tels que l'hydroxyde de sodium ou de potassium, dont les constantes de basicité sont si grandes qu'elles ne peuvent pas être mesurées dans l'eau..
Par contre, une base faible est une base dont la constante de dissociation est faible donc elle est en équilibre chimique.
Des exemples de ceux-ci sont l'ammoniac et les amines dont les constantes d'acidité sont de l'ordre de 10-4. La figure 1 montre les différentes constantes d'acidité pour différentes bases.
pH supérieur à 7
L'échelle de pH mesure l'alcalinité ou le niveau d'acidité d'une solution. L'échelle varie de zéro à 14. Un pH inférieur à 7 est acide. Un pH supérieur à 7 est basique. Le point médian 7 représente un pH neutre. Une solution neutre n'est ni acide ni alcaline.
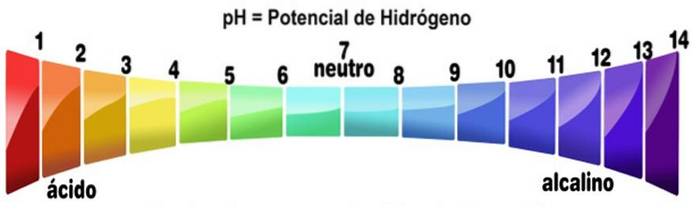
L'échelle de pH est obtenue en fonction de la concentration en H+ dans la solution et lui est inversement proportionnelle. Les bases, en diminuant la concentration de protons, augmentent le pH d'une solution.
Capacité à neutraliser les acides
Arrhenius, dans sa théorie, propose que les acides, en étant capables de générer des protons, réagissent avec l'hydroxyle des bases pour former du sel et de l'eau de la manière suivante:
HCl + NaOH → NaCl + HdeuxOU ALORS.
Cette réaction est appelée neutralisation et est à la base de la technique analytique appelée titrage..
Capacité de réduction d'oxyde
Compte tenu de leur capacité à produire des espèces chargées, les bases sont utilisées comme milieu de transfert d'électrons dans les réactions redox..
Les bases ont également tendance à s'oxyder car elles ont la capacité de donner des électrons libres..
Les bases contiennent des ions OH-. Ils peuvent agir pour donner des électrons. L'aluminium est un métal qui réagit avec les bases.
2Al + 2NaOH + 6HdeuxO → 2NaAl (OH)4+3Hdeux
Ils ne corrodent pas de nombreux métaux, car les métaux ont tendance à perdre plutôt qu'à accepter des électrons, mais les bases sont très corrosives pour les substances organiques comme celles qui composent la membrane cellulaire..
Ces réactions sont généralement exothermiques, ce qui provoque de graves brûlures au contact de la peau, ce type de substance doit donc être manipulé avec précaution. La figure 3 est l'indicateur de sécurité lorsqu'une substance est corrosive.

Ils libèrent OH-
Pour commencer, l'OH- Il peut être présent dans de nombreux composés, principalement dans les hydroxydes métalliques, car en compagnie des métaux, il a tendance à «arracher» les protons pour former de l'eau. Ainsi, une base peut être toute substance qui libère cet ion en solution grâce à un équilibre de solubilité:
M (OH)deux <=> Mdeux+ + 2OH-
Si l'hydroxyde est très soluble l'équilibre est totalement déplacé vers la droite de l'équation chimique et on parle d'une base forte. M (OH)deux , au lieu de cela, c'est une base faible, car elle ne libère pas complètement ses ions OH- dans l'eau. Une fois l'OH- produit peut neutraliser tout acide qui l'entoure:
Oh- + HA => A- + HdeuxOU ALORS
Et donc le OH- déprotonate l'acide HA pour le transformer en eau. Parce que? Parce que l'atome d'oxygène est très électronégatif et a également une densité électronique excessive en raison de la charge négative.
O a trois paires d'électrons libres et peut donner n'importe laquelle d'entre elles à l'atome H partiellement chargé positivement, δ +. De même, la grande stabilité énergétique de la molécule d'eau favorise la réaction. En d'autres termes: HdeuxOu il est beaucoup plus stable que l'AH, et lorsque cela est vrai, la réaction de neutralisation se produira.
Bases conjuguées
Et qu'en est-il de OH- déjà-? Les deux sont des bases, à la différence que A- est le base conjuguée acide HA. En outre, un- est une base beaucoup plus faible que OH-. De là, la conclusion suivante est atteinte: une base réagit pour en générer une plus faible.
Base Fort + Acide Fort => Base Faible + Acide Faible
Comme le montre l'équation chimique générale, il en va de même pour les acides.
Base conjuguée A- peut déprotoner une molécule dans une réaction appelée hydrolyse:
À- + HdeuxOU ALORS <=> HA + OH-
Cependant, contrairement à OH-, il établit un équilibre lorsqu'il est neutralisé avec de l'eau. Encore une fois, c'est parce qu'un- c'est une base beaucoup plus faible, mais suffisante pour produire un changement du pH de la solution.
Par conséquent, tous ces sels qui contiennent A- ils sont connus sous le nom de sels basiques. Un exemple de ceux-ci est le carbonate de sodium, NadeuxCO3, qui, après dissolution, basifie la solution par la réaction d'hydrolyse:
CO3deux- + HdeuxOU ALORS <=> HCO3- + Oh-
Ils ont des atomes d'azote ou des substituants qui attirent la densité électronique
Une base n'est pas que des solides ioniques avec des anions OH- dans leur réseau cristallin, ils peuvent également avoir d'autres atomes électronégatifs comme l'azote. Ces types de bases appartiennent à la chimie organique, et parmi les plus courants sont les amines.
Quel est le groupe amine? R-NHdeux. Sur l'atome d'azote, il y a une paire électronique non partagée, qui peut, ainsi que l'OH-, déprotoner une molécule d'eau:
R-NHdeux + HdeuxOU ALORS <=> RNH3+ + Oh-
L'équilibre est fortement déplacé vers la gauche, car l'amine, bien que basique, est beaucoup plus faible que OH-. Notez que la réaction est similaire à celle donnée pour la molécule d'ammoniaque:
NH3 + HdeuxOU ALORS <=> NH4+ + Oh-
Seules les amines ne peuvent pas former correctement le cation, NH4+; bien que RNH3+ est le cation ammonium avec une monosubstitution.
Et peut-il réagir avec d'autres composés? Oui, avec toute personne qui a suffisamment d'hydrogène acide, même si la réaction ne se produit pas complètement. Autrement dit, seule une amine très forte réagit sans établir l'équilibre. De même, les amines peuvent donner leur paire d'électrons à des espèces autres que H (comme les radicaux alkyles: -CH3).
Bases avec anneaux aromatiques
Les amines peuvent également avoir des cycles aromatiques. Si sa paire d'électrons peut être «perdue» à l'intérieur de l'anneau, parce que l'anneau attire la densité d'électrons, alors sa basicité diminuera. Parce que? Parce que plus ladite paire est localisée dans la structure, plus elle réagira rapidement avec les espèces pauvres en électrons.
Par exemple, NH3 il est basique car sa paire d'électrons n'a nulle part où aller. Il en va de même avec les amines, qu'elles soient primaires (RNHdeux), secondaire (RdeuxNH) ou tertiaire (R3N). Ceux-ci sont plus basiques que l'ammoniac car, en plus de ce qui vient d'être expliqué, l'azote attire des densités électroniques plus élevées des substituants R, augmentant ainsi δ-.
Mais lorsqu'il y a un cycle aromatique, ledit couple peut entrer en résonance en son sein, rendant impossible de participer à la formation de liaisons avec H ou d'autres espèces. Par conséquent, les amines aromatiques ont tendance à être moins basiques, à moins que la paire d'électrons ne reste fixée sur l'azote (comme avec la molécule de pyridine).
Exemples de bases
NaOH
L'hydroxyde de sodium est l'une des bases les plus utilisées dans le monde. Ses applications sont innombrables, mais parmi elles on peut citer son utilisation pour saponifier certaines graisses et ainsi fabriquer des sels basiques d'acides gras (savons).
CH3LCO3
Structurellement, l'acétone peut sembler ne pas accepter les protons (ou donner des électrons), mais c'est le cas, même si c'est une base très faible. En effet, l'atome O électronégatif attire les nuages d'électrons des groupes CH.3, accentuant la présence de ses deux paires d'électrons (: O :).
Hydroxydes alcalins
Mis à part NaOH, les hydroxydes de métaux alcalins sont également des bases fortes (à la légère exception de LiOH). Ainsi, parmi d'autres bases, il y a les suivantes:
-KOH: potasse ou potasse caustique, c'est l'une des bases les plus utilisées en laboratoire ou dans l'industrie, en raison de son grand pouvoir dégraissant.
-RbOH: hydroxyde de rubidium.
-CsOH: hydroxyde de césium.
-FrOH: hydroxyde de francium, dont la basicité est théoriquement présumée être l'une des plus fortes jamais connues.
Bases organiques
-CH3CHdeuxNHdeux: éthylamine.
-LiNHdeux: amide de lithium. Avec l'amide de sodium, NaNHdeux, ils sont l'une des bases organiques les plus fortes. En eux, l'anion amide, NHdeux- c'est la base qui déprotone l'eau ou réagit avec les acides.
-CH3ONa: méthylate de sodium. Ici la base est l'anion CH3OU ALORS-, qui peut réagir avec les acides pour donner du méthanol, CH3Oh.
-Réactifs de Grignard: ont un atome de métal et un halogène, RMX. Dans ce cas, le radical R est la base, mais pas précisément parce qu'il enlève un hydrogène acide, mais parce qu'il abandonne sa paire d'électrons qu'il partage avec l'atome métallique. Par exemple: bromure d'éthylmagnésium, CH3CHdeuxMgBr. Ils sont très utiles en synthèse organique.
NaHCO3
Le bicarbonate de soude est utilisé pour neutraliser l'acidité dans des conditions douces, par exemple à l'intérieur de la bouche comme additif dans les dentifrices.
Les références
- Merck KGaA. (2018). Bases organiques. Tiré de: sigmaaldrich.com
- Wikipédia. (2018). Bases (chimie). Tiré de: es.wikipedia.org
- Chimie 1010. Acides et bases: ce qu'ils sont et où ils se trouvent. [PDF]. Tiré de: cactus.dixie.edu
- Acides, bases et échelle de pH. Tiré de: 2.nau.edu
- Le groupe Bodner. Définitions des acides et des bases et rôle de l'eau. Tiré de: chemed.chem.purdue.edu
- Chimie LibreTexts. Bases: propriétés et exemples. Tiré de: chem.libretexts.org
- Shiver et Atkins. (2008). Chimie inorganique. Au Acides et bases. (quatrième édition). Mc Graw Hill.
- Helmenstine, Todd. (04 août 2018). Noms de 10 bases. Récupéré de: thinkco.com



Personne n'a encore commenté ce post.