
Hydrogènes de benzylbenzyle, carbocations, radicaux benzyl
le benzyle ou benzyle est un groupe substituant courant en chimie organique dont la formule est C6H5CHdeux- ou Bn-. Structurellement, il consiste simplement en l'union d'un groupe méthylène, CHdeux, avec un groupe phényle, C6H5; c'est-à-dire un carbone sp3 directement lié à un cycle benzénique.
Par conséquent, le groupe benzyle peut être vu comme un cycle aromatique attaché à une petite chaîne. Dans certains textes, l'utilisation de l'abréviation Bn est préférable à C6H5CHdeux-, étant facilement reconnaissable dans n'importe quel composé; en particulier lorsqu'il est attaché à un atome d'oxygène ou d'azote, O-Bn ou NBndeux, respectivement.

Ce groupe se trouve également implicitement dans un certain nombre de composés largement connus. Par exemple, à l'acide benzoïque, C6H5COOH, pourrait être considéré comme un benzyle dont le carbone sp3 il a subi une oxydation importante; ou benzaldéhyde, C6H5CHO, issu d'une oxydation partielle; et alcool benzylique, C6H5CHdeuxOH, encore moins rouillé.
Un autre exemple quelque peu évident de ce groupe peut être trouvé dans le toluène, C6H5CH3, qui peuvent subir un certain nombre de réactions du fait de la stabilité inhabituelle résultant des radicaux benzyle ou des carbocations. Cependant, le groupe benzyle sert à protéger les groupes OH ou NH.deux de réactions qui modifient de manière indésirable le produit à synthétiser.
Index des articles
- 1 Exemples de composés avec un groupe benzyle
- 2 hydrogènes benzyliques
- 3 carbocations et radicaux benzyle
- 3.1 Résonance dans le groupe benzyle
- 3.2 Autres radicaux
- 4 réactions
- 5 Références
Exemples de composés avec un groupe benzyle
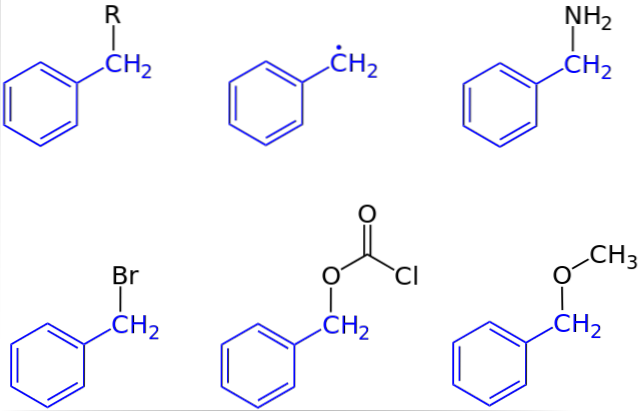
Dans la première image, la représentation générale d'un composé avec un groupe benzyle a été montrée: C6H5CHdeux-R, où R peut être n'importe quel autre fragment moléculaire ou atome. Ainsi, en faisant varier R, un nombre élevé d'exemples peut être obtenu; certains simples, d'autres juste pour une région spécifique d'une structure ou d'un ensemble plus grand.
L'alcool benzylique, par exemple, est dérivé de la substitution de OH par R: C6H5CHdeux-OH. Si au lieu de OH c'est le groupe NHdeux, puis le composé benzylamine se produit: C6H5CHdeux-NHdeux.
Si Br est l'atome qui remplace R, le composé résultant est le bromure de benzyle: C6H5CHdeux-Br; R pour COdeuxCl donne naissance à un ester, le chlorocarbonate de benzyle (ou le chlorure de carbobenzoxyle); et LCO3 donne du benzylméthyléther, C6H5CHdeux-LCO3.
Même (mais pas tout à fait correctement), R peut être supposé par un électron isolé: le radical benzyle, C6H5CHdeux·, Produit de la libération du radical R ·. Un autre exemple, bien que non inclus dans l'image, est le phénylacétonitrile ou le cyanure de benzyle, C6H5CHdeux-CN.
Il existe des composés dans lesquels le groupe benzyle représente à peine une région spécifique. Dans ce cas, l'abréviation Bn est souvent utilisée pour simplifier la structure et ses illustrations..
Hydrogènes benzyliques
Les composés ci-dessus ont en commun non seulement le cycle aromatique ou phényle, mais également des hydrogènes benzyliques; ce sont ceux qui appartiennent au carbone sp3.
Ces hydrogènes peuvent être représentés par: Bn-CH3, Bn-CHdeuxR ou Bn-CHRdeux. Le composé Bn-CR3 manque d'hydrogène benzylique, et donc sa réactivité est inférieure à celle des autres.
Ces hydrogènes sont différents de ceux qui sont généralement attachés à un carbone sp3.
Par exemple, considérons le méthane, CH4, qui peut aussi s'écrire CH3-H.Pour la rupture du lien CH3-H dans une décomposition hétérolytique (formation de radicaux), une certaine quantité d'énergie doit être fournie (104kJ / mol).
Cependant, l'énergie pour la même rupture de liaison C6H5CHdeux-H est plus faible que le méthane (85 kJ / mol). Puisque cette énergie est inférieure, cela implique que le radical C6H5CHdeuxIl est plus stable que CH3·. La même chose se produit à un degré plus ou moins grand avec d'autres hydrogènes benzyliques.
Par conséquent, les hydrogènes benzyliques sont plus réactifs pour générer des radicaux ou carbocations plus stables que ceux provoqués par d'autres hydrogènes. Parce que? La question est répondue dans la section suivante.
Carbocations et radicaux benzyle
Le radical C était déjà envisagé6H5CHdeux·, Manquant de carbocation benzylique: C6H5CHdeux+. Dans le premier il y a un électron solitaire non apparié, et dans le second une déficience électronique. Les deux espèces sont très réactives et représentent des composés transitoires dont proviennent les produits finaux de la réaction..
Carbone sp3, après avoir perdu un ou deux électrons pour former le radical ou le carbocation, respectivement, il peut adopter l'hybridation spdeux (plan trigonal), de manière à ce qu'il y ait le moins de répulsion possible entre ses groupes électroniques. Mais, s'il se trouve que c'est spdeux, Comme les carbones du cycle aromatique, une conjugaison peut-elle se produire? La réponse est oui.
Résonance dans le groupe benzyle
Cette conjugaison ou résonance est le facteur clé pour expliquer la stabilité de ces espèces dérivées du benzyle ou du benzyle. L'image suivante illustre un tel phénomène:
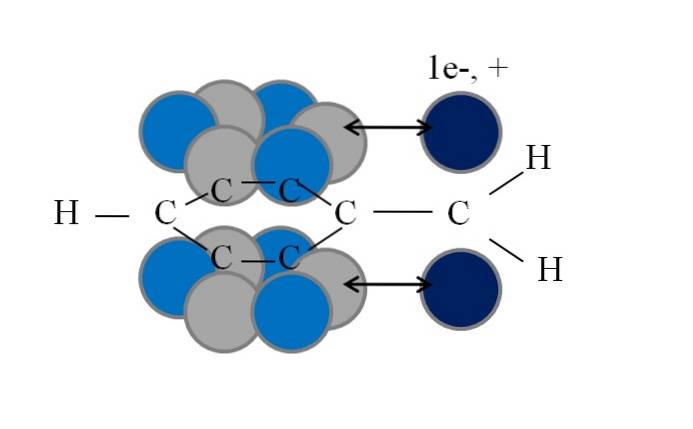
Notez que là où se trouvait l'un des hydrogènes benzyliques, une orbitale est restée p avec un électron non apparié (radical, 1e-), ou vide (carbocation, +). Comme on peut le voir, cette orbitale p est parallèle au système aromatique (les cercles gris et bleu clair), la double flèche indiquant le début de la conjugaison.
Ainsi, à la fois l'électron non apparié et la charge positive peuvent être transférés ou dispersés à travers le cycle aromatique, car le parallélisme de leurs orbitales le favorise géométriquement. Cependant, ceux-ci ne se trouvent dans aucune orbitale p anneau aromatique; uniquement dans ceux appartenant aux carbones en positions ortho et para par rapport à CHdeux.
C'est pourquoi les cercles bleu clair se détachent au-dessus des cercles gris: en eux la densité négative ou positive du radical ou du carbocation, respectivement, est concentrée..
Autres radicaux
Il convient de mentionner que cette conjugaison ou résonance ne peut pas se produire dans les carbones sp3 le plus éloigné de l'anneau aromatique.
Par exemple, le radical C6H5CHdeuxCHdeuxIl est beaucoup plus instable car l'électron non apparié ne peut pas se conjuguer avec l'anneau lorsque le groupe CH intervientdeux entre et avec l'hybridation sp3. Il en va de même pour C6H5CHdeuxCHdeux+.
Réactions
En résumé: les hydrogènes benzyliques ont tendance à réagir, générant soit un radical soit un carbocation, qui à son tour finit par provoquer le produit final de la réaction. Par conséquent, ils réagissent via un mécanisme SN.1.
Un exemple est la bromation du toluène sous rayonnement ultraviolet:
C6H5CH3 + 1 / 2Brdeux => C6H5CHdeuxBr
C6H5CHdeuxBr + 1 / 2Brdeux => C6H5CHBrdeux
C6H5CHBrdeux + 1 / 2Brdeux => C6H5CBr3
En fait, dans cette réaction, des radicaux Br sont produits..
D'autre part, le groupe benzyle lui-même réagit pour protéger les groupes OH ou NH.deux dans une simple réaction de substitution. Ainsi, un alcool ROH peut être `` benzylé '' en utilisant du bromure de benzyle et d'autres réactifs (KOH ou NaH):
ROH + BnBr => ROBn + HBr
ROBn est un éther benzylique, auquel son groupe OH initial peut être renvoyé s'il est soumis à un milieu réducteur. Cet éther doit rester inchangé pendant que d'autres réactions sont effectuées sur le composé..
Les références
- Morrison et R.T. et Boyd, R. N. (1987). Chimie organique. (5e édition). Addison-Wesley Iberoamericana.
- Carey, F. A. (2008). Chimie organique. (6e édition). McGraw-Hill, Interamerica, Editores S.A.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (10e édition.). Wiley plus.
- Wikipédia. (2019). Groupe benzyle. Récupéré de: en.wikipedia.org
- Dr Donald L. Robertson. (5 décembre 2010). Phényle ou benzyle? Récupéré de: home.miracosta.edu
- Gamini Gunawardena. (2015, 12 octobre). Carbocation benzylique. Chimie LibreTexts. Récupéré de: chem.libretexts.org



Personne n'a encore commenté ce post.