
Structure, propriétés, utilisations, production du bisulfite de sodium (NaHSO3)

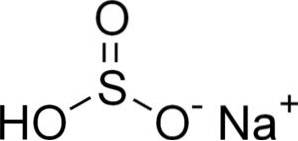
le Bisulfite de sodium est un solide inorganique formé par un ion sodium Na+ et un ion bisulfite HSO3-. Sa formule chimique est NaHSO3. C'est un solide cristallin blanc et en raison de ses propriétés antioxydantes, il est largement utilisé comme conservateur alimentaire (par exemple dans certaines confitures).
Le NaHSO3 c'est un composé chimique réducteur, qui est l'opposé de l'oxydant, et pour cette raison il agit comme un antioxydant dans beaucoup de ses applications, comme dans les produits comestibles, car il empêche leur détérioration.

Cependant, cette utilisation a été remise en question car des cas d'asthme ont été signalés chez des personnes après avoir mangé des aliments contenant du bisulfite de sodium. On dit même qu'il détruit la vitamine B1 dans ces.
Les organisations internationales de santé ont limité son utilisation aux micro-quantités dans les aliments.
Cependant, le bisulfite de sodium a de nombreuses autres utilisations, comme dans l'obtention d'iode, comme anti-infectieux, pour blanchir les tissus, pour la digestion du bois lors de la préparation de la pâte à papier, comme désinfectant pour les barriques de bière et de vin., Etc..
Index des articles
- 1 Structure chimique
- 2 Nomenclature
- 3 propriétés
- 3.1 État physique
- 3.2 Poids moléculaire
- 3.3 Point de fusion
- 3.4 Densité
- 3.5 Solubilité
- 3,6 pH
- 3.7 Propriétés chimiques
- 3.8 Risques
- 4 Obtention
- 5 utilisations
- 5.1 Dans l'industrie des pâtes et papiers
- 5.2 Dans l'industrie alimentaire
- 5.3 Polémique sur son utilisation dans les aliments
- 5.4 Dans les applications agricoles
- 5.5 Pour obtenir de l'iode
- 5.6 Dans l'industrie du meuble et du bois
- 5.7 Dans diverses applications
- 6 Références
Structure chimique
Le bisulfite de sodium est composé d'un cation sodium Na+ et un anion bisulfite HSO3-.
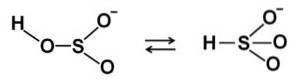
Dans les solutions aqueuses, le bisulfite forme 4 espèces. En solution diluée, il existe un équilibre entre les structures illustrées ci-dessous:
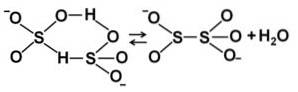
Lorsque la concentration augmente, deux molécules de bisulfite interagissent l'une avec l'autre, formant l'ion pyrosulfite SdeuxOU ALORS5deux-:
Nomenclature
-Bisulfite de sodium
-Hydrogénosulfite de sodium
-Hydrosulfite de sodium.
Propriétés
État physique
Cristallin blanc solide.
Poids moléculaire
104,06 g / mol
Point de fusion
Il se décompose.
Densité
1,48 g / cm3 à 20 ºC.
Solubilité
Soluble dans l'eau: 29 g / 100 g d'eau.
pH
Ses solutions sont acides, avec un pH compris entre 2,5 et 5,5.
Propriétés chimiques
En solution aqueuse de bisulfite de sodium NaHSO3 se sépare en ses ions: le cation sodium Na+ et l'anion bisulfite HSO3-.
Si le bisulfite de sodium est exposé à l'air, il perd un peu de SOdeux et s'oxyde lentement en sulfate de NadeuxSW4.
S'il est chauffé jusqu'à décomposition, il émet des fumées d'oxydes de soufre et de monoxyde de sodium..
C'est un agent réducteur, qui est l'opposé de l'oxydant. Et pour cette raison, il peut se comporter comme un antioxydant.
Il a une légère odeur de soufre. Ce n'est pas inflammable.
Des risques
Bisulfite de sodium NaHSO3 c'est un irritant puissant pour la peau et les tissus. La poussière irrite les yeux, le nez et la gorge. En cas d'ingestion, il irrite l'estomac. De fortes doses peuvent provoquer des coliques violentes, de la diarrhée, de la dépression et la mort..
Il n'est pas combustible mais s'il est chauffé, il produit des gaz irritants et toxiques.
Obtention
Il est préparé en saturant une solution de carbonate de sodium NadeuxCO3 avec du dioxyde de soufre SOdeux et cristallise en solution.
Applications
Dans l'industrie des pâtes et papiers
Le NaHSO3 Il est utilisé dans la digestion du bois, pour qu'il devienne plus tard du papier. Il sert également d'agent de blanchiment pour la pulpe.
Il est également utilisé pour éliminer le chlore lorsque la pâte à papier a été blanchie avec..
Dans l'industrie alimentaire
Le bisulfite de sodium, en raison de sa propriété réductrice, agit comme un antioxydant.
Il est utilisé comme agent de conservation dans un grand nombre d'aliments et de boissons, y compris le vin et la bière, pour éviter la détérioration et améliorer la saveur.
Il est utilisé pour blanchir les aliments, tels que certains amidons comestibles.
Il réduit ou empêche la détérioration des aliments, permet de conditionner la pâte utilisée dans les produits de boulangerie et sert à ramollir les grains de maïs pendant le broyage humide, entre autres utilisations.
En plus de contrôler la fermentation du vin et de la bière, il agit comme un antiseptique dans sa préparation car il sert de stérilisateur et de fongicide en barriques et en cuves..

Dans les fruits secs, il se trouve à des concentrations supérieures à 100 ppm (ppm signifie «parties par million»), dans de nombreux autres aliments, il se trouve à des concentrations comprises entre 10 et 100 ppm, comme les pommes de terre surgelées et séchées, les cornichons, les sauces et les confitures.

Polémique sur son utilisation dans les aliments
Les effets toxiques immédiats et à long terme du bisulfite de sodium dans les aliments suscitent des inquiétudes. Il y a des opinions divergentes.
Des effets indésirables ont été signalés chez des patients souffrant d'asthme, qui est une maladie respiratoire, après l'ingestion d'aliments avec NaHSO3. D'autres sources indiquent que l'ion bisulfite peut détruire la vitamine B1 ou la thiamine.

Cependant, certains chercheurs ont découvert en 1985 que le bisulfite de sodium sert à protéger contre les radiations et les agents chimiques, et inhibe ou empêche la transformation des cellules en cancer. Les faibles doses sont les meilleures.
Cet effet protecteur a été expliqué en fonction de ses propriétés réductrices ou antioxydantes et que de cette manière il pourrait attaquer les radicaux libres.
D'autre part, l'Organisation mondiale de la santé, ou l'OMS (pour son acronyme en anglais Organisation mondiale de la santé), recommande comme niveau acceptable d'apport quotidien d'environ 0,7 mg / kg du poids de la personne.
Cela signifie qu'il est recommandé de ne pas dépasser ce montant..
La Food and Drug Administration des États-Unis, ou USFDA. US Food and Drug Administration), classé bisulfite de sodium comme "généralement reconnu comme sûr".
Dans les applications agricoles
NaHSO utilisé à de faibles concentrations3 sert de régulateur de croissance des plantes, pour améliorer la photosynthèse et favoriser le rendement des cultures.
Il a été testé à cet effet dans différents types de plantes, comme les fraisiers et les théiers..

C'est l'ingrédient actif de nombreux pesticides et biocides.
En milieu aquatique, il peut également accélérer la transformation de certains herbicides en produits moins toxiques en éliminant le chlore..
Pour obtenir de l'iode
Le NaHSO3 est le composé réducteur utilisé pour libérer l'iode de l'iodate de sodium NaIO3. C'est l'un des moyens d'obtenir de l'iode à partir de sources telles que la nitro du Chili ou certaines eaux salines.
Après cristallisation du nitrate de sodium à partir de la solution brute de nitrate du Chili, il reste une solution de NaIO3 qui est traité avec du bisulfite de sodium NaHSO3, produisant de l'iode libre.
2 NaIO3 + 5 NaHSO3 → 3 NaHSO4 + N / AdeuxSW4 + jedeux
Dans l'industrie du meuble et du bois
Le NaHSO3 Il a été testé pour modifier les protéines de soja et améliorer leurs propriétés d'adhérence avec le bois afin de coller des morceaux de bois entre eux pour préparer par exemple des panneaux de particules, du carton ou du papier mâché, du contreplaqué, etc. Tout cela pour les meubles ou les planches, parmi diverses applications.

Ceci est fait pour remplacer les adhésifs traditionnels à base de formaldéhyde, car à la fois dans leur processus de fabrication et pendant leur utilisation, ils ont tendance à libérer du formaldéhyde dans l'atmosphère, qui est un composé toxique..
Le bisulfite de sodium améliore la teneur en solides de l'adhésif aux protéines de soja, et diminue sa viscosité, améliorant sa fluidité afin qu'il pénètre mieux les pores du bois, augmentant sa cohésion avec lui et entre les pièces..
L'adhésif aux protéines de soja modifiées par NaHSO3 a une bonne résistance à l'eau et une excellente stabilité au stockage grâce à l'action antioxydante du bisulfite de sodium.
Cela confirme que les adhésifs aux protéines de soja modifiés par NaHSO3 sont comparables aux adhésifs à base de formaldéhyde et peuvent être utilisés dans l'industrie du meuble et du bois, étant moins polluants.
Dans diverses applications
Il a de multiples utilisations, généralement basées sur ses propriétés réductrices (qui sont le contraire de l'oxydant). Voici quelques applications.
-En photographie.
-En tannage du cuir, pour enlever les poils des peaux.
-Usages thérapeutiques: anti-infectieux. Il est utilisé comme antioxydant dans certains collyres.
-Dans l'extraction de gaz naturel par fracturation hydraulique.
-Dans la coloration des fibres, il est utilisé pour la préparation de baignoires chaudes ou froides, pour solubiliser certains colorants ou colorants.
-En tant que réducteur de lessive ou de blanchiment, pour blanchir la laine, la soie et les fibres végétales.
-Dans les laboratoires de chimie pour éliminer les taches de permanganate sur la peau et les vêtements. Dans les laboratoires de biochimie comme conservateur de liquides ou de solutions qui peuvent se détériorer avec le temps. En tant que réactif chimique.
-Pour la coagulation du latex de caoutchouc.
-Dans l'industrie cosmétique en tant qu'antioxydant.
-Désinfectant et javellisant.
-Dans le traitement des eaux usées pour éliminer le chlore utilisé dans la dernière étape de la désinfection et pour rejeter l'eau déjà traitée dans l'environnement.

Les références
- NOUS. Bibliothèque nationale de médecine. (2019). Bisulfite de sodium. Récupéré de pubchem.ncbi.nlm.nih.gov.
- Qi, G. et coll. (2013). Adhérence et propriétés physicochimiques de la protéine de soja modifiées par le bisulfite de sodium. J Am Oil Chem Soc (2013) 90: 1917-1926. Récupéré de aocs.onlinelibrary.wiley.com.
- Borek, C. et al. (1985). Le bisulfite de sodium protège contre la transformation radiogène et induite chimiquement dans les cellules C3H / 10T-1/2 d'embryon de hamster et de souris. Toxicol Ind Health 1985Sep; 1 (1): 69-74. Récupéré de journals.sagepub.com.
- Friedler, E. et coll. (2015). Une approche de surveillance active continue pour identifier les interconnexions entre les systèmes de distribution d'eau potable et d'effluents. Environ Monit Assess (2015) 187: 131. Récupéré de link.springer.com.
- Cotton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley et fils.
- Programme Sunnyvale Cleanwater. (2019). Plan directeur de l'usine de contrôle de la pollution de l'eau. Récupéré de sunnyvalecleanwater.com.
- Barros Santos, C. (2008). Additifs dans l'alimentation des Espagnols et la législation qui régit leur autorisation et leur utilisation. Livres de vision. Récupéré de books.google.co.ve.



Personne n'a encore commenté ce post.