
Histoire du Borax, structure, propriétés, utilisations, synthèse, risques
le borax ou borate de sodium est une désignation pour un groupe de composés chimiques avec une formule de base NadeuxB4OU ALORS7. C'est un sel hygroscopique capable de former de nombreux hydrates, en plus d'être enrichi structurellement par la présence de certaines impuretés métalliques.
Les principaux composés qui reçoivent le nom de borax sont les suivants: tétraborate de sodium anhydre, NadeuxB4OU ALORS7; tétraborate de sodium pentahydraté (NadeuxB4OU ALORS7) .5HdeuxOU ALORS; et tétraborate de sodium décahydraté, NadeuxB4OU ALORS7.10HdeuxOu, ou son équivalent, tétraborate de sodium octahydraté, NadeuxB4OU ALORS5(OH)4.8HdeuxOU ALORS.

Comme on peut l'apprécier, tous les solides ci-dessus ne diffèrent que par leur degré d'hydratation; certains ont plus de molécules d'eau dans leurs cristaux que d'autres. Physiquement, le borax ressemble à des morceaux solides ou à des cristaux de craie (image du haut).
Le borax se trouve naturellement dans les sédiments lacustres saisonniers, séchés par évaporation. Le borax est produit en Turquie, dans les lacs de Searles (Californie), dans le désert d'Atacama, au Chili, en Bolivie, au Tibet et en Roumanie. Les cristaux de borax peuvent être obtenus synthétiquement par un processus de nucléation lent; c'est-à-dire celui dans lequel la croissance des cristaux est favorisée.
Le tétraborate de sodium, anhydre et décahydraté, est peu soluble dans l'eau froide; mais sa solubilité augmente avec l'augmentation de la température. Puis undeuxB4OU ALORS7.10HdeuxOu il est très soluble dans l'éthylène glycol, modérément soluble dans l'éthanol et légèrement soluble dans l'acétone; ce sont des solvants moins polaires que l'eau.
Borax a de nombreuses applications, comme dans la fabrication de détergents et de savons; comme retardateur de feu pour les matériaux cellulosiques; dans la production de fibre de verre; dans le nettoyage de surfaces dures telles que les métaux, le verre et la céramique; et dans l'inhibition de la corrosion, entre autres utilisations.
Le borax est irritant pour les yeux, la peau et les voies respiratoires. Par ingestion, il peut produire, entre autres symptômes, des vomissements, de la diarrhée, une flaccidité, des caries et des convulsions. Actuellement, on soupçonne qu'il peut avoir des effets nocifs sur la reproduction humaine.
Index des articles
- 1 Histoire
- 2 Structure du borax
- 3 cristaux
- 3.1 Confusions avec l'anion borate
- 4 propriétés
- 4.1 Noms
- 4.2 Masse moléculaire
- 4.3 Apparence physique
- 4.4 Densité
- 4.5 Point de fusion
- 4.6 Point d'ébullition
- 4.7 Solubilité dans l'eau
- 4.8 Solubilité dans les solvants organiques
- 4.9 Indice de réfraction (ηD)
- 4.10 Stabilité
- 4.11 Émission lumineuse
- 4.12 Réactions
- 5 utilisations
- 5.1 Action antioxydante
- 5.2 Fabrication d'adhésifs
- 5.3 Ignifuge
- 5.4 Fabrication de verre borosilicaté (Pyrex)
- 5.5 Émulsifiant
- 5.6 Matériel de nettoyage
- 5.7 Utilisations médicales
- 5,8 tampon pH
- 5.9 Diminution de la dureté de l'eau
- 5.10 Engrais et compost
- 5.11 Préservation du bois
- 5.12 Flux et flux
- 5.13 Autres
- 6 Synthèse
- 7 risques
- 8 Références
Histoire
L'histoire du borax est déroutante. On dit qu'il a été découvert dans le lit d'un lac au Tibet, asséché par évaporation. Il a été transféré au 8ème siècle du Tibet à l'Arabie saoudite, suivant la soi-disant route de la soie.
Le terme «borax» est devenu populaire à la suite des nombreuses applications qui ont été trouvées et commercialisées sous le nom de 20 Mule Team Borax Tradermax, qui faisait référence à la façon dont le borax était transporté à travers les déserts du Nevada et de la Californie..
Une autre version de sa découverte indique que les Égyptiens connaissaient son existence depuis longtemps, l'utilisant dans le soudage des métaux par la chaleur. De plus, ils l'ont utilisé en médecine et dans le processus de momification. Borax a été transféré en Europe au 13ème siècle par Marco Polo.
Au milieu du XIXe siècle, de grands gisements de borax ont été découverts dans le désert de Mogave, qui a rendu son utilisation courante depuis..
Structure du borax

L'image du haut montre les ions qui composent le borax, correspondant spécifiquement à un solide avec une formule de composition de Nadeux[B4OU ALORS5(OH)4] · 8HdeuxO (ou NadeuxB4OU ALORS710HdeuxOU ALORS).
Tout d'abord, la structure en cage de l'anion [B4OU ALORS5(OH)4]deux- (bien qu'il devrait avoir deux groupes -OH déprotonés, -O-), dans lequel un anneau octogonal (quatre atomes B et quatre O) peut être vu, avec un pont B-O-B le divisant en deux moitiés.
Cette cage ne reste pas statique, mais vibre et adopte différentes formes dans l'espace; cependant, dans une moindre mesure à proximité du pont. Aussi, on peut remarquer qu'il est très "oxygéné"; c'est-à-dire qu'il a de nombreux atomes d'oxygène, capables d'interagir avec les molécules d'eau via des liaisons hydrogène.
Il n'est donc pas surprenant que les cristaux de borax puissent s'hydrater et générer de nombreux hydrates. Ainsi, pour le solide Nadeux[B4OU ALORS5(OH)4] · 8HdeuxOu, il y a huit molécules de HdeuxOu interagir avec la cage borate, et en même temps, avec les centres métalliques de Na+.
Côté cation, on a le complexe aqueux [Na (HdeuxOU ALORS)4]+n, où la valeur de n dépendra du rapport anion / cation. Dans le solide supérieur, n = 2, nous avons donc: [Nadeux(HdeuxOU ALORS)8]deux+, dont la charge 2+ neutralise la charge 2- de l'anion borate.
Cristaux
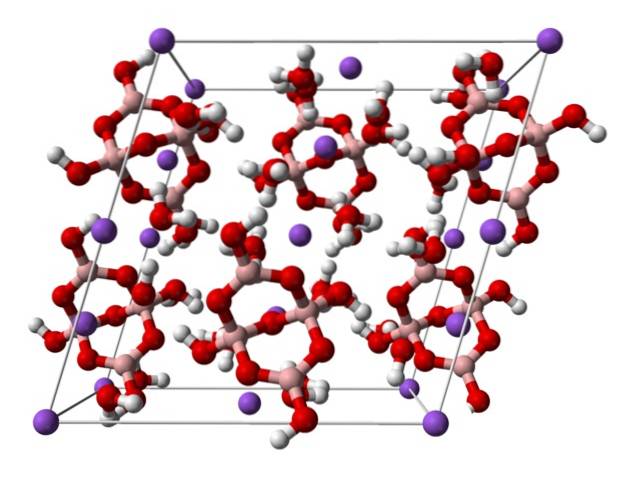
domaine].
Ci-dessus se trouve la cellule unitaire monoclinique pour les cristaux de Nadeux[B4OU ALORS5(OH)4] · 8HdeuxO ou NadeuxB4OU ALORS710HdeuxO. Ici, les attractions électrostatiques et les liaisons hydrogène régissent ou dominent les modèles structurels originaires de chaque travée du cristal..
Les autres hydrates et le sel anhydre perdent une ou toutes leurs molécules d'eau, modifiant la composition et la structure du cristal de borax. Dans tous, l'anion et le cation restent les mêmes (sauf s'il y a des impuretés ou des réactions secondaires), il ne peut donc y avoir aucune confusion à cet égard..
Confusions avec l'anion borate
N / Adeux[B4OU ALORS5(OH)4] · 8HdeuxO et NadeuxB4OU ALORS710HdeuxOu ce sont les mêmes. Parce que?
En premier lieu, si vous comptez ses atomes, on verra qu'ils coïncident en nombre; et deuxièmement, dans l'anion B4OU ALORS7deux- on considère l'absence des deux groupes OH liés aux têtes bore des ponts B-O-B; deux OH qui, avec les deux H+ venant de B4OU ALORS7deux-, ajouter 2 HdeuxOu, ce qui donne un total de 10 HdeuxOu (8 + 2).
Propriétés
Des noms
- Borax.
- Borate de sodium.
- Tétraborate de sodium.
- Tétraborate de disodium.
Masse moléculaire
Anhydre: 201,22 g / mol.
Décahydrate: 381,38 g / mol.
Apparence physique
Un solide cristallin blanc.
Densité
Anhydre: 2,4 g / cm3
Décahydraté: 1739 g / cm3
Point de fusion
Anhydre: 743 ° C (1 369 ° F, 1 016 K).
Décahydrate: 75 ºC.
Point d'ébullition
Anhydre: 1 575 ° C (2 867 ° F, 1 848 K).
Solubilité dans l'eau
31,78 g / L (à la fois anhydre et décahydraté).
Solubilité dans les solvants organiques
Il est très soluble dans l'éthylène glycol, modérément soluble dans le diéthylène glycol et le méthanol, et légèrement soluble dans l'acétone..
Indice de réfraction (ηD)
Anhydre: η1 = 1 447; ηdeux = 1 469.
Décahydrate: ηdeux = 1 472.
Stabilité
Il est stable dans des conditions de stockage appropriées. Bien qu'il ait une faible pression de vapeur, il augmente avec la température, conduisant à la cristallisation et à la condensation, de sorte que les fluctuations excessives de température et d'humidité doivent être évitées..
Émission lumineuse
Le tétraborate de sodium soumis à l'action du feu émet une lumière verte.
Réactions
- Lorsqu'il se dissout dans l'eau, il produit des solutions alcalines avec un pH d'environ 9,2.
- Le borax réagit pour former d'autres borates, tels que le perborate (PBS).
- Il produit également de l'acide borique en réagissant avec l'acide chlorhydrique:
N / AdeuxB4OU ALORS710HdeuxO + HCl => 4 H3BO3 + 2 Na+ + 2 cl- + 5 heuresdeuxOU ALORS
- Le tétraborate de sodium se comporte comme une substance amphotère, car en solution aqueuse, il s'hydrolyse et est capable de neutraliser les acides. De la même manière, il est capable de neutraliser des alcalis à haute concentration, évitant une élévation excessive du pH du milieu..
Applications
Borax a de nombreuses applications, tant chez l'homme que dans toutes les activités qu'il exerce..
Action antioxydante
Le borax a la capacité de dissoudre les oxydes. Pour cette raison, il est utilisé dans la récupération de métaux tels que le laiton, le cuivre, le plomb et le zinc..
Il est également utilisé pour empêcher l'oxydation des barres métalliques dans les fonderies. Le borax recouvre sa surface, à l'exclusion de l'air, et empêche donc l'oxydation. De plus, il empêche la corrosion des matériaux ferreux dans la fabrication automobile.
La solubilité du borax dans l'éthylène glycol a été utile dans les formulations antigel. Le borax neutralise les résidus acides qui sont produits lors de la décomposition de l'éthylène glycol, minimisant l'oxydation que la surface des métaux peut subir.
Fabrication d'adhésifs
- Borax fait partie d'une formulation adhésive à base d'amidon pour papier et carton ondulé.
- C'est un agent peptisant dans la fabrication d'adhésifs à base de caséine et de dextrine.
- Il agit en renforçant les matériaux adhésifs grâce à la réticulation de groupes hydroxyles conjugués.
Retardateur de flamme
Il est utilisé comme ignifuge dans les matériaux cellulosiques et autres polymères contenant des groupes hydroxyle. Il exerce son action à travers différents mécanismes, dont la formation d'une couche vitreuse qui limite l'accès aux carburants.
Fabrication de verre borosilicaté (Pyrex)
Le borax est une source de bore utilisée dans la fabrication du verre borosilicaté; caractérisé par un point de fusion élevé, un faible coefficient de dilatation et une résistance élevée aux chocs thermiques.
Cela lui permet d'être soumis à des températures élevées sans subir de fractures, recevant le nom de verre réfractaire..
Le verre borosilicaté est utilisé dans la fabrication de matériaux à utiliser à la maison pour cuire des aliments. Il est également utilisé dans les laboratoires dans des béchers, des flacons, des éprouvettes graduées, des pipettes, etc..
Émulsifiant
Le borax, avec d'autres composés, est utilisé pour émulsionner les savons et autres paraffines. Il est également utilisé comme base pour la production de lotions, crèmes et onguents..
Les fournitures de nettoyage
- Il est ajouté dans des formulations pour nettoyer les surfaces fermes telles que les métaux, le verre et la céramique.
- Il est utilisé dans les nettoyants pour les mains, les matériaux de polissage et les savons détergents à utiliser dans les blanchisseries et à la maison. De plus, il facilite l'élimination des dépôts huileux des planchers d'usine.
Utilisations médicales
- Il est utilisé dans le traitement des infections fongiques des pieds.
- Il fait partie de la formule des nutriments qui fournissent du bore. On pense que cet élément est impliqué dans le métabolisme du calcium, du phosphore et du magnésium et peut être nécessaire à la structure osseuse.
- Il est impliqué dans la détermination de l'hémoglobine glycosylée (HbA1C), un test qui sert à déterminer le développement à long terme du diabète chez un patient, puisque la demi-vie d'un érythrocyte est de 120 jours.
Ces informations sont plus utiles pour le clinicien que les mesures individuelles de glycémie du patient..
Tampon PH
Il est utilisé dans divers systèmes tampons utilisés en biochimie; parmi eux, le Tris (hydroxyméthyl) aminométhane-borate, utilisé dans l'électrophorèse sur polyacrylamide d'acides nucléiques d'ADN et d'ARN.
Diminution de la dureté de l'eau
Le borax est capable de se combiner avec les ions calcium et magnésium présents dans l'eau, réduisant leur concentration. De cette façon, la dureté de l'eau est réduite.
Engrais et compost
Le borax est utilisé comme source de bore. Le calcium et le bore sont impliqués dans la formation de la paroi cellulaire végétale. De plus, il a été souligné que le bore favorise la pollinisation, c'est pourquoi il intervient dans la fertilisation et la prolifération des plantes.
Préservation du bois
Borax combat le ver du bois, un coléoptère qui consomme et détruit le bois. Il est également utilisé dans la conservation et l'entretien des bateaux en bois.
Flux et flux
Il est utilisé comme fondant dans le soudage de l'acier et du fer, provoquant une diminution du point de fusion et l'élimination de l'oxyde de fer; un contaminant indésirable. Dans un même but, il participe à la soudure de l'or et de l'argent.
Autres
- Il est utilisé comme pesticide doux; par exemple, pour lutter contre les mites sur la laine.
- La pulvérisation est utilisée pour lutter contre les ravageurs présents dans les armoires, les réservoirs internes, dans les creux des murs, et en général, où l'utilisation de pesticides plus polluants n'est pas souhaitée..
- Il est utilisé dans les réacteurs nucléaires pour contrôler les réactions qui pourraient produire, dans les cas extrêmes, une réaction en chaîne.
- Dans les radiateurs de voiture, le borax est utilisé pour bloquer les endroits où il y a des fuites d'eau.
La synthèse
Le borax est obtenu en faisant réagir l'ulexite minérale, composée des éléments bore, sodium et calcium, avec la formule NaCaB5OU ALORS9.8HdeuxOu, avec du carbonate de sodium et de l'hydrocarbonate de sodium en milieu aqueux.
En fait, la synthèse du tétraborate de sodium ou du borax est peu utilisée; la majeure partie du composé produit est obtenue par l'extraction des minéraux qui le contiennent.
Le procédé peut se résumer à une dissolution du minerai dans l'eau, suivie d'une filtration dans l'argile et enfin d'une évaporation de la solution aqueuse.
Des risques
Le borax est un produit naturel, cependant, il peut causer une série de dommages à la santé humaine. Par exemple, le contact avec la poudre de borax peut provoquer une irritation cutanée pouvant entraîner une dermatite..
De même, le borax provoque une irritation des yeux et des voies respiratoires supérieures. Les symptômes de son inhalation comprennent la toux et le mal de gorge.
Pendant ce temps, la prise de borax présente les symptômes suivants: vomissements, nausées, diarrhée, flaccidité, maux de tête et convulsions. De plus, le système nerveux central et la fonction rénale peuvent être affectés..
À partir d'études menées sur des rats mâles nourris avec du borax, une atrophie testiculaire a été observée chez eux. Alors que des études menées sur des rates gravides ont indiqué que le borax pouvait traverser le placenta, entraînant une altération du développement fœtal, se manifestant par un faible poids à la naissance..
On pense que l'exposition au borax affecte la fonction reproductrice masculine chez les hommes, se manifestant par une réduction du nombre de spermatozoïdes.
Une dose mortelle de 10 à 25 grammes est estimée pour l'apport en borax chez l'adulte.
Les références
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Centre national d'information sur la biotechnologie. (2019). Argon. Base de données PubChem. CID = 23968. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Karolyn Burns, Seneca Joseph et le Dr Ryan Baumbach. (s.f.). Synthèse et propriétés des cristaux de borax et des alliages intermétalliques. Récupéré de: nationalmaglab.org
- Wikipédia. (2019). Borax. Récupéré de: en.wikipedia.org
- Rio Tinto. (2019). Borax décahydraté. 20 Mule Team Borax. Récupéré de: borax.com
- Fletcher Jenna. (14 janvier 2019). Le borax est-il sûr à utiliser? Récupéré de: medicalnewstoday.com



Personne n'a encore commenté ce post.