
Caractéristiques du butène, structure chimique et utilisations
le butène est le nom donné à une série de quatre isomères de formule chimique C4H8. Ce sont des alcènes ou des oléfines, c'est-à-dire qu'ils ont une double liaison C = C dans leur structure. De plus, ce sont des hydrocarbures, que l'on peut trouver dans les champs pétrolifères ou qui sont issus du craquage thermique et qui permettent d'obtenir des produits de poids moléculaire inférieur..
Les quatre isomères réagissent avec l'oxygène, libérant de la chaleur et une flamme jaune. De même, ils peuvent réagir avec un large spectre de petites molécules qui s'ajoutent à leur double liaison..
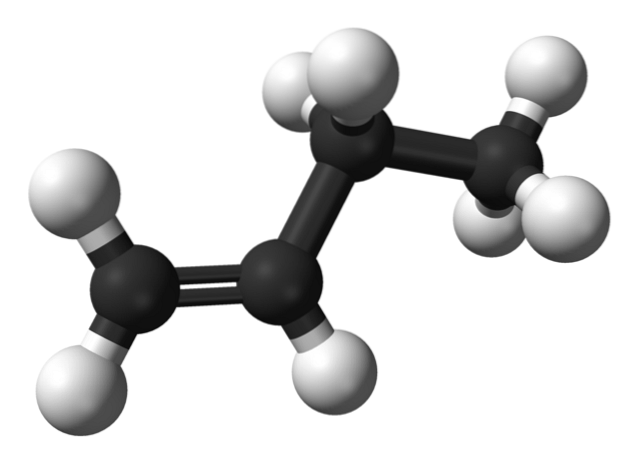
Mais quels sont les isomères du butène? Dans l'image du haut, la structure est représentée par des sphères blanches (hydrogènes) et noires (carbones) pour le 1-butène. Le 1-butène est l'isomère le plus simple de l'hydrocarbure C4H8. Notez qu'il y a huit sphères blanches et quatre sphères noires, ce qui correspond à la formule chimique.
Les trois autres isomères sont le cis et le trans 2-butène et l'iso-butène. Tous présentent des propriétés chimiques très similaires, bien que leurs structures entraînent des variations de propriétés physiques (points de fusion et d'ébullition, densités, etc.). En outre, leurs spectres IR ont des modèles similaires de bandes d'absorption..
Familièrement, le 1-butène est appelé butène, bien que le 1-butène ne se réfère qu'à un seul isomère et non à un nom générique. Ces quatre composés organiques sont des gaz, mais ils peuvent se liquéfier à des pressions élevées ou se condenser (et même cristalliser) avec une diminution de la température..
Ils sont une source de chaleur et d'énergie, des réactifs pour la synthèse d'autres composés organiques et, surtout, nécessaires à la fabrication de caoutchouc artificiel après la synthèse du butadiène..
Index des articles
- 1 Caractéristiques du butène
- 1.1 Poids moléculaire
- 1.2 Aspects physiques
- 1.3 Point d'ébullition
- 1.4 Point de fusion
- 1.5 Solubilité
- 1.6 Densité
- 1.7 Réactivité
- 2 Structure chimique
- 2.1 Isomères constitutionnels et géométriques
- 2.2 Stabilité
- 2.3 Forces intermoléculaires
- 3 utilisations
- 4 Références
Caractéristiques du butène
Poids moléculaire
56,106 g / mol. Ce poids est le même pour tous les isomères de formule C4H8.
Aspects physiques
C'est un gaz incolore et inflammable (comme les autres isomères), et a une odeur relativement aromatique..
Point d'ébullition
Les points d'ébullition des isomères du butène sont les suivants:
1-Butène: -6ºC
Cis-2-butène: 3,7 ° C
Trans-2-butène: 0,96 ° C
2-méthylpropène: -6,9 ° C
Point de fusion
1-Butène: -185,3 ° C
Cis-2-butène: -138,9 ° C
Trans-2-Butène: -105,5 ° C
2-méthylpropène: -140,4 ° C
Solubilité
Le butène est très insoluble dans l'eau en raison de sa nature non polaire. Cependant, il se dissout parfaitement dans certains alcools, le benzène, le toluène et les éthers..
Densité
0,577 à 25 ° C Par conséquent, il est moins dense que l'eau et dans un récipient, il serait situé au-dessus..
Réactivité
Comme tout alcène, sa double liaison est susceptible d'ajouter des molécules ou de s'oxyder. Cela rend le butène et ses isomères réactifs. D'autre part, ce sont des substances inflammables, donc lorsqu'elles sont surchauffées, elles réagissent avec l'oxygène de l'air..
Structure chimique
Dans l'image du haut, la structure du 1-butène est représentée. À sa gauche, vous pouvez voir l'emplacement de la double liaison entre le premier et le deuxième carbone. La molécule a une structure linéaire, bien que la région autour de la liaison C = C soit plate en raison de l'hybridation spdeux de ces carbones.
Si la molécule de 1-butène était tournée à un angle de 180 °, elle aurait la même molécule sans changements apparents, par conséquent, elle manque d'activité optique.
Comment ses molécules interagiraient-elles? Les liaisons C-H, C = C et C-C sont de nature apolaire, donc aucune d'elles ne collabore à la formation d'un moment dipolaire. Par conséquent, les molécules CHdeux= CHCHdeuxCH3 doit interagir au moyen des forces de dispersion de Londres.
L'extrémité droite du butène forme des dipôles instantanés qui, à courte distance, polarisent les atomes adjacents d'une molécule voisine. De son côté, l'extrémité gauche de la liaison C = C interagit en superposant les nuages π les uns sur les autres (comme deux plaquettes ou feuilles).
Parce qu'il y a quatre atomes de carbone qui composent le squelette moléculaire, leurs interactions sont à peine suffisantes pour que la phase liquide ait un point d'ébullition de -6 ° C..
Isomères constitutionnels et géométriques
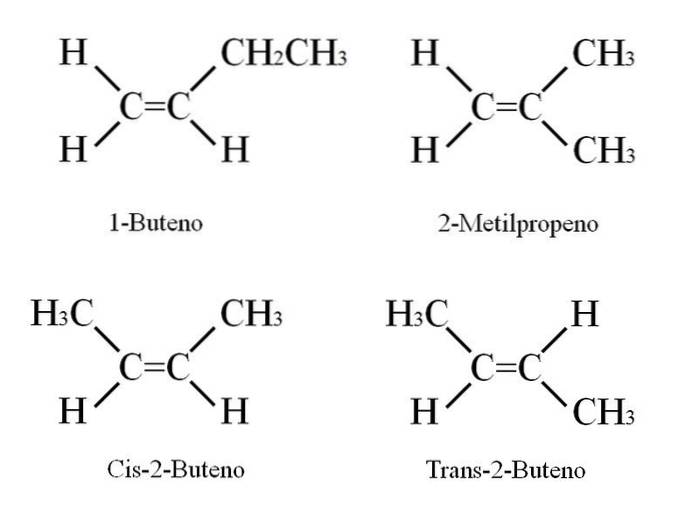
Le 1-butène a la formule moléculaire C4H8; Cependant, d'autres composés peuvent avoir la même proportion d'atomes C et H dans leur structure..
Comment est-ce possible? Si la structure du 1-butène est étroitement observée, les substituants sur les carbones C = C peuvent être échangés. Cet échange produit d'autres composés à partir du même squelette. De plus, la position de la double liaison entre C-1 et C-2 peut se déplacer vers C-2 et C-3: CH3CH = CHCH3, 2-butène.
Dans le 2-butène, les atomes H peuvent être situés du même côté de la double liaison, ce qui correspond au stéréoisomère cis; ou dans une orientation spatiale opposée, dans le stéréoisomère trans. Les deux constituent ce que l'on appelle également les isomères géométriques. Il en va de même pour les groupes -CH3.
Notez également que s'il était laissé dans la molécule CH3CH = CHCH3 les atomes H d'un côté et les groupes CH3 dans un autre, on obtiendrait un isomère constitutionnel: CHdeux= C (CH3)deux, 2-méthylpropène (également connu sous le nom d'isobutène).
Ces quatre composés ont la même formule C4H8 mais des structures différentes. Le 1-butène et le 2-méthylpropène sont des isomères constitutionnels; et cis et trans-2-butène, isomères géométriques entre eux deux (et constitutionnels par rapport au reste).
Stabilité
Chaleur de combustion
D'après l'image ci-dessus, lequel des quatre isomères représente la structure la plus stable? La réponse peut être trouvée, par exemple, dans les chaleurs de combustion de chacun d'eux. En réagissant avec l'oxygène, l'isomère de formule C4H8 se transforme en COdeux libérer de l'eau et de la chaleur:
C4H8(g) + 6Odeux(g) => 4COdeux(g) + 4HdeuxO (g)
La combustion est exothermique, donc plus il y a de chaleur dégagée, plus l'hydrocarbure est instable. Par conséquent, l'un des quatre isomères qui dégage le moins de chaleur lors de la combustion dans l'air sera le plus stable..
Les chaleurs de combustion pour les quatre isomères sont:
-1-Butène: 2717 kJ / mol
-cis-2-butène: 2710 kJ / mol
-trans-2-butène: 2707 kJ / mol
-2-méthylpropène: 2700 kJ / mol
Notez que le 2-méthylpropène est l'isomère qui dégage le moins de chaleur. Alors que le 1-butène est celui qui dégage le plus de chaleur, ce qui se traduit par une plus grande instabilité.
Effet stérique et électronique
Cette différence de stabilité entre les isomères peut être déduite directement de la structure chimique. Selon les alcènes, celui qui a le plus de substituants R acquiert une plus grande stabilisation de sa double liaison. Ainsi, le 1-butène est le plus instable car il n'a guère de substituant (-CHdeuxCH3); c'est-à-dire qu'il est monosubstitué (RHC = CHdeux).
Les isomères cis et trans du 2-butène diffèrent en énergie en raison de la contrainte de Van der Wall causée par l'effet stérique. Dans l'isomère cis, les deux groupes CH3 du même côté de la double liaison, ils se repoussent, tandis que dans l'isomère trans, ils sont suffisamment éloignés l'un de l'autre.
Mais pourquoi alors le 2-méthylpropène est-il l'isomère le plus stable? Parce que l'effet électronique intercède.
Dans ce cas, même s'il s'agit d'un alcène disubstitué, les deux groupes CH3 ils sont sur le même carbone; en position géminée les uns par rapport aux autres. Ces groupes stabilisent le carbone de la double liaison, lui donnant une partie de son nuage d'électrons (car il est relativement plus acide en raison de l'hybridation sp).deux).
De plus, dans le 2-butène, ses deux isomères n'ont que 2º de carbone; tandis que le 2-méthylpropène contient un 3ème carbone, avec une plus grande stabilité électronique.
Forces intermoléculaires
La stabilité des quatre isomères suit un ordre logique, mais pas les forces intermoléculaires. Si l'on compare leurs points de fusion et d'ébullition, on constatera qu'ils n'obéissent pas au même ordre.
On pourrait s'attendre à ce que le trans-2-butène présente les forces intermoléculaires les plus élevées en raison d'un plus grand contact de surface entre deux molécules, contrairement au cis-2-butène, dont le squelette dessine un C.Cependant, le cis-2-butène bout à une température plus élevée (3,7 ° C), que l'isomère trans (0,96 ° C).
On s'attend à des points d'ébullition similaires pour le 1-butène et le 2-méthylpropène car ils sont structurellement très similaires. Cependant, à l'état solide, la différence change radicalement. Le 1-butène fond à -185,3 ° C, tandis que le 2-méthylpropène à -140,4 ° C.
De plus, l'isomère cis-2-butène fond à -138,9 ° C, à une température très proche du 2-méthylpropène, ce qui peut signifier que dans le solide ils présentent une disposition également stable..
À partir de ces données, on peut conclure que, bien que connaissant les structures les plus stables, elles n'éclairent pas suffisamment la connaissance du fonctionnement des forces intermoléculaires dans le liquide; et plus encore, dans la phase solide de ces isomères.
Applications
-Les butènes, compte tenu de leur chaleur de combustion, peuvent simplement être utilisés comme source de chaleur ou de combustibles. Ainsi, on s'attend à ce que la flamme de 1-butène se réchauffe plus que celle des autres isomères..
-Peut être utilisé comme solvants organiques.
-Ils servent d'additifs pour augmenter le niveau d'octane de l'essence.
-Au sein de la synthèse organique, le 1-butène participe à la production d'autres composés tels que: l'oxyde de butylène, le 2-glutanol, le succinimide et le tert-butylmécaptan (utilisé pour donner au gaz de cuisson son odeur caractéristique). De même, le butadiène (CHdeux= CH-CH = CHdeux), à partir de laquelle le caoutchouc artificiel est synthétisé.
Au-delà de ces synthèses, la diversité des produits dépendra des molécules ajoutées à la double liaison. Par exemple, des halogénures d'alkyle peuvent être synthétisés s'ils sont mis à réagir avec des halogènes; les alcools, s'ils ajoutent de l'eau en milieu acide; et les esters de tert-butyle s'ils ajoutent des alcools de bas poids moléculaire (comme le méthanol).
Les références
- Francis A. Carey. Chimie organique. Acides carboxyliques. (sixième éd., pages 863-866). Mc Graw Hill.
- Wikipédia. (2018). Butène Tiré de: es.wikipedia.org
- YPF. (Juillet 2017). Buten nous. [PDF]. Tiré de: ypf.com
- William Reusch. (5 mai 2013). Réactions d'addition d'alcènes. Récupéré de: 2.chemistry.msu.edu
- PubChem. (2018). 1-Butène. Récupéré de: pubchem.ncbi.nlm.nih.gov



Personne n'a encore commenté ce post.