
Chauffer les formules données, comment le calculer et les exercices résolus
le chaleur cédée est le transfert d'énergie entre deux corps à des températures différentes. Celui dont la température est la plus élevée cède la chaleur à celui dont la température est la plus basse. Qu'un corps renonce ou absorbe de la chaleur, sa température ou son état physique peut varier en fonction de la masse et des caractéristiques du matériau dont il est fait..
Un bon exemple est dans une tasse de café fumant. La cuillère en métal avec laquelle le sucre est mélangé se réchauffe. S'il reste assez longtemps dans la tasse, le café et une cuillère en métal finiront par égaliser leurs températures: le café aura refroidi et la cuillère aura chauffé. Un peu de chaleur aura pénétré dans l'environnement, car le système n'est pas isolé.

Lorsque les températures s'égalisent, le équilibre thermique.
Si vous faisiez le même test avec une cuillère à café en plastique, vous remarquerez sûrement qu'elle ne chauffe pas aussi rapidement que celle en métal, mais elle finira par s'équilibrer avec le café et tout ce qui l'entoure..
En effet, le métal conduit mieux la chaleur que le plastique. D'un autre côté, le café produit sûrement de la chaleur à une vitesse différente de celle du chocolat chaud ou d'une autre boisson. Ainsi, la chaleur donnée ou absorbée par chaque objet dépend du matériau ou de la substance dont il est fait..
Index des articles
- 1 De quoi il s'agit et ses formules
- 1.1 La différence de température ΔT
- 1.2 Chaleur spécifique et capacité calorifique d'une substance
- 2 Comment le calculer?
- 2.1 Calorimétrie
- 3 exercices résolus
- 3.1 Exercice 1
- 3.2 Exercice 2
- 4 Références
De quoi il s'agit et formules
La chaleur fait toujours référence au flux ou au transit d'énergie entre un objet et un autre, en raison de la différence de température.
C'est pourquoi on parle de chaleur transférée ou de chaleur absorbée, car en ajoutant ou en extrayant de la chaleur ou de l'énergie d'une certaine manière, il est possible de modifier la température d'un élément.
La quantité de chaleur dégagée par l'objet le plus chaud est généralement appelée Q. Cette valeur est proportionnelle à la masse dudit objet. Un corps avec une masse importante est capable de produire plus de chaleur qu'un autre avec une masse plus faible..
Différence de température ΔT
Un autre facteur important dans le calcul de la chaleur dégagée est la différence de température ressentie par l'objet qui libère la chaleur. Il est noté ΔT et il est calculé comme ceci:
ΔT = TF - Tou alors
Enfin, la quantité de chaleur transférée dépend également de la nature et des caractéristiques de l'objet, qui sont résumées quantitativement dans une constante appelée chaleur spécifique du matériau, dénoté comme c.
Donc, finalement, l'expression de la chaleur transférée est la suivante:
Qa abouti = - m.c.ΔT
Céder est symbolisé par un signe négatif.
Chaleur spécifique et capacité thermique d'une substance
La chaleur spécifique est la quantité de chaleur nécessaire pour élever la température de 1 g de substance de 1 ºC. C'est une propriété intrinsèque du matériau. Ses unités dans le système international sont: Joule / kg. K (Joule entre kilogramme x température en degrés Kelvin).
La capacité thermique C est un concept lié, mais légèrement différent, car la masse de l'objet est impliquée. La capacité thermique est définie comme suit:
C = mc
Ses unités en S.I. ce sont Joule / K. Ainsi, la chaleur dégagée peut également être exprimée de manière équivalente par:
Q = -C. ΔT
Comment le calculer?
Pour calculer la chaleur dégagée par un objet, il est nécessaire de connaître les éléments suivants:
- La chaleur spécifique de la substance qui cède la chaleur.
- La masse de ladite substance
- La température finale pour obtenir
Les valeurs thermiques spécifiques de nombreux matériaux ont été déterminées expérimentalement et sont disponibles dans des tableaux.
Calorimétrie
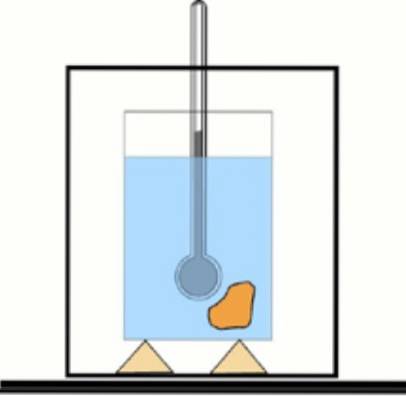
Or, si cette valeur n'est pas connue, il est possible de l'obtenir à l'aide d'un thermomètre et d'eau dans un récipient thermiquement isolé: le calorimètre. Un schéma de cet appareil est présenté dans la figure qui accompagne l'exercice 1.
Un échantillon de la substance à une certaine température est immergé dans une quantité d'eau préalablement mesurée. La température finale est mesurée et la chaleur spécifique du matériau est déterminée avec les valeurs obtenues..
En comparant le résultat avec les valeurs tabulées, on peut savoir de quelle substance il s'agit. Cette procédure s'appelle calorimétrie.
Le bilan thermique est réalisé en économisant l'énergie:
Q a abouti + Q absorbé = 0
Exercices résolus
Exercice 1
Un morceau de cuivre de 0,35 kg est introduit à une température de 150 ° C dans 500 mL d'eau à une température de 25 ° C. Trouver:
a) La température d'équilibre finale
b) Combien de chaleur circule dans ce processus?
Données
ccuivre = 385 J / kg. ºC
ceau = 4180 J / kg. ºC
Densité de l'eau: 1000 kg / m3
Solution
a) Le cuivre cède la chaleur tandis que l'eau l'absorbe. Le système étant considéré comme fermé, seuls l'eau et l'échantillon interviennent dans le bilan thermique:
Q a abouti = Q absorbé
En revanche, il faut calculer la masse de 500 mL d'eau:
500 mL = 0,5 L = 0,0005 m3
Avec ces données, la masse de l'eau est calculée:
masse = densité x volume = 1000 kg / m3 . 0,0005 m3 = 0,5 kg
L'équation de la chaleur dans chaque substance est élevée:
Qa abouti = -mcuivre . ccuivre. ΔT = -0,35 kg. 385 J / kg. ° C . (TF -150 ºC) = -134,75 (TF - 150) J
Qabsorbé = mL'eau . cL'eau. ΔT = 0,5 kg. 4186 J / kg. ºC. (TF -25 ºC) = 2093 (TF -25) J
En comparant les résultats, nous avons:
2093 (TF - 25) = -134,75 (TF - 150)
C'est une équation linéaire à une inconnue, dont la solution est:
TF = 32,56 ºC
b) La quantité de chaleur qui s'écoule est la chaleur transférée ou la chaleur absorbée:
Q a abouti = - 134,75 (32,56 - 150) J = 15823 J
Q absorbé = 2093 (32,56 - 25) J = 15823 J
Exercice 2
Un morceau de cuivre de 100 g est chauffé dans un four à une température Tou alors puis il est introduit dans un calorimètre en cuivre de 150 g contenant 200 g d'eau à 16 ° C. La température finale une fois à l'équilibre est de 38 ° C. Lorsque le calorimètre et son contenu sont pesés, on constate qu'ils ont évaporé 1,2 g d'eau. la température initiale Tou alors?
Données: la chaleur latente de vaporisation de l'eau est Lv = 2257 kJ / kg
Solution
Cet exercice diffère du précédent, car il faut considérer que le calorimètre absorbe également la chaleur. La chaleur dégagée par le morceau de cuivre est investie dans tous les éléments suivants:
- Chauffer l'eau dans le calorimètre (200 g)
- Chauffer le cuivre dont est fabriqué le calorimètre (150 g)
- Évaporez 1,2 gramme d'eau (de l'énergie est également nécessaire pour un changement de phase).
Qa abouti = -100 X 1 x 10 -3 kg. 385 J / kg. ºC. (38 - Tou alors ) ºC = -38,5. (38 - Tou alors) J
Q absorbé par calorimètre = Q absorbé par l'eau + Q vaporisation + Q absorbé par le cuivre
0,2 kg .4186 J / kg ºC. (38 - 16 ºC) + 1,2 x 10-3 kg. 2257000 J / kg +0,150 kg .385 J / kg .ºC. (38 - 16 ºC) =
18418,4 +2708,4 + 1270,5 J = 22397,3 J
Donc:
-38,5. (38 - Tou alors) = 22397,3
Tou alors = 619,7 ºC
La chaleur nécessaire pour porter les 1,2 g d'eau à 100 ° C aurait également pu être prise en compte, mais c'est assez peu en comparaison..
Les références
- Giancoli, D. 2006. Physique: principes avec applications. 6e. Ed. Prentice Hall. 400 - 410.
- Kirkpatrick, L. 2007. Physique: un regard sur le monde. 6ta Edition abrégée. Apprentissage Cengage. 156 - 164.
- Rex, A. 2011. Fondamentaux de la physique. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Physique universitaire et physique moderne. 14e. Éd. Volume 1. 556 - 553.
- Serway, R., Vulle, C. 2011. Principes de base de la physique. 9n / A Apprentissage Cengage.



Personne n'a encore commenté ce post.