
Caractéristiques des acides et des bases

Les caractéristiques des acides et des bases sont toutes ces propriétés et qualités avec lesquelles on peut distinguer entre un acide et une base..
Selon la théorie d'Arrehnius, un acide est une substance qui libère des protons H+ lorsqu'il est dissous dans l'eau, et un base est une substance qui libère des ions hydroxyles OH- en solution aqueuse.
| Acides | Bases | |
|---|---|---|
| Formation d'ions | Cadeau | Cadeau |
| Réaction de neutralisation | Quand tu réagis avec une base. | Quand il réagit avec un acide. |
| Solubilité dans l'eau | Soluble | Partiellement soluble. Les hydroxydes de calcium, de baryum et d'aluminium sont peu solubles. |
| Conductivité électrique | Cadeau | Cadeau |
| État de la matière | Solide, liquide ou gazeux | Solide, liquide ou gazeux |
| Réaction avec du papier de tournesol | Coloration rouge | Coloration bleue |
| PH | Moins de 7 ans | Supérieur à 7 |
| Homologue conjugué | Un acide faible forme une base conjuguée. | Une base faible forme un acide conjugué. |
| Effet corrosif | Acides forts | Des bases solides |
Caractéristiques des acides
Les acides ont plusieurs caractéristiques avec lesquelles ils peuvent être identifiés.
Capacité à former des ions à partir d'acides
La principale caractéristique des substances acides est qu'elles peuvent être ionisées, c'est-à-dire perdre ou gagner des électrons.
L'acide chlorhydrique HCl, un acide fort, s'ionise pour former un anion chlorure Cl- et proton H+.
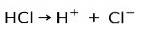
Réaction de neutralisation
Un acide réagit avec une base pour former un sel et de l'eau. Cette réaction est connue sous le nom de réaction de neutralisation. Par exemple, HCl réagit avec NaOH pour former du chlorure de sodium NaCl (sel de cuisine) et de l'eau:
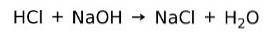
Hydrosolubilité des acides
Les acides sont généralement solubles dans l'eau. Par exemple, l'acide chlorhydrique ou l'acide chlorhydrique est modérément soluble dans l'eau, jusqu'à 82 g de HCl peuvent être dissous dans 100 ml d'eau à 0 ° C. Dans le cas de l'acide sulfurique HdeuxSW4, le mélange avec de l'eau génère de la chaleur, il est donc toujours conseillé d'ajouter l'acide à l'eau pour éviter les explosions.
Force acide
La façon dont les acides se dissocient détermine s'ils sont forts ou faibles. La force d'un acide est donnée par son constante de dissociation.
Acide nitrique HNO3 c'est un acide fort car en solution aqueuse, il s'ionise complètement en protons et en ions nitrate:
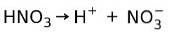
Cela signifie que lorsque nous ajoutons HNO3 dans l'eau, lors de l'analyse de l'eau, nous ne trouverons que H+ et des ions nitrate, et pratiquement pas de HNO3.
Au lieu de cela, l'acide acétique présent dans le vinaigre est un acide faible, car seule une partie est dissociée:
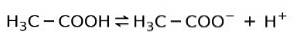
C'est pourquoi il est représenté par des flèches dans deux directions, cela signifie qu'en solution aqueuse nous aurons de l'acide acétique, H+ et l'anion acétate (H3C-COO-).
États de la matière des acides
Les acides peuvent être trouvés à l'état liquide, solide ou gazeux. Par exemple, l'acide chlorhydrique HCl est liquide, le sulfure d'hydrogène HS est un gaz et l'acide oxalique est un solide..
Réaction avec du papier de tournesol à partir d'acides

Lorsque nous plaçons une bande de papier de tournesol dans une substance acide, le papier de tournesol devient rouge.
Identification des acides par leur pH
PH est la mesure de la quantité de H+ présent dans une solution. Ainsi, entre pH 0 et 7, on est en présence d'un acide. Par exemple, le vinaigre a un pH égal à 2, le pH de l'acide sulfurique dans les batteries de voiture est égal à 1.
Conductivité électrique des acides
Étant donné que les acides peuvent se dissocier et produire des ions chargés électriquement, les solutions acides peuvent conduire l'électricité. Par exemple, à l'intérieur des batteries de voiture, de l'acide sulfurique est utilisé, qui est un acide fort comme conducteur d'électricité..
Effet corrosif des acides forts
Les acides forts ont un effet corrosif, ils peuvent brûler les tissus organiques donc leur manipulation doit être extrêmement prudente.
Les acides faibles forment une contrepartie conjuguée
Les acides faibles lorsqu'ils sont dissous forment ce que l'on appelle une paire conjuguée, c'est-à-dire qu'un acide faible forme une base conjuguée.
Par exemple:
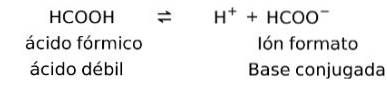
Dans ce cas, l'acide formique ou méthanoïque (HCOOH), lorsqu'il est dissocié, forme le format d'ion base conjugué.
Cela peut vous intéresser:
- Acides et bases forts et faibles.
- Exemples d'acides et de bases.
Caractéristiques des bases
Ensuite, nous présentons les propriétés des bases ou des solutions alcalines qui les caractérisent.
Capacité d'ionisation de base
Les substances basiques ou alcalines se caractérisent par la formation d'ions lorsqu'elles sont dissoutes dans l'eau:
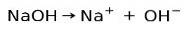
Dans ce cas, l'hydroxyde de sodium NaOH s'ionise pour former un anion hydroxyde OH- et un cation sodium Na+.
Une base réagit avec un acide pour former un sel
Une base réagit avec un acide dans une réaction de neutralisation pour former de l'eau et un sel, par exemple:
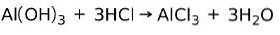
Dans ce cas, l'hydroxyde d'aluminium Al (OH)3, une base, réagit avec HCl et forme le sel de chlorure d'aluminium AlCl3 et de l'eau. L'hydroxyde d'aluminium est utilisé comme antiacide pour soulager le reflux gastrique en neutralisant l'acide produit par l'estomac.
Bases la solubilité dans l'eau
Certaines bases sont solubles dans l'eau. Les hydroxydes alcalino-terreux, tels que l'hydroxyde de calcium et l'hydroxyde de baryum, sont peu solubles dans l'eau. Par exemple, l'hydroxyde de sodium ou la soude caustique peuvent être dissous 109 g dans 100 ml d'eau à 20 ° C. Alors que l'hydroxyde de magnésium ou le lait de magnésie Mg (OH)deux est pratiquement insoluble dans l'eau.
Force de base
Selon le degré d'ionisation de la base, ceux-ci peuvent être forts ou faibles. Par exemple, l'hydroxyde de lithium est un base solide car en solution aqueuse il s'ionise complètement en ions hydroxyde OH et en cations lithium Li+:
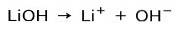
D'autre part, l'ammoniac NH3 c'est une base faible car au contact de l'eau, tout l'ammoniac ne se dissocie pas:
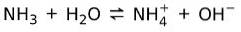
État de base de la matière
Les bases peuvent être trouvées à l'état solide, liquide et gazeux. Par exemple, l'hydroxyde de sodium pur est solide, l'ammoniac est un gaz.
Réaction avec le papier tournesol des bases
Lorsque nous plaçons une bande de papier de tournesol dans une substance alcaline, le papier devient bleu.
Identification des bases par leur pH
Les bases se caractérisent par un pH compris entre 7 et 14.
 Conductivité électrique des bases
Conductivité électrique des bases
Les bases en raison de leur capacité d'ionisation sont de bons conducteurs d'électricité. Par exemple, dans les piles alcalines, l'hydroxyde de potassium KOH est utilisé comme conducteur électrique..
Effet corrosif des bases
Des bases fortes peuvent endommager les tissus organiques. Par exemple, les nettoyants pour fours de cuisine sont généralement des bases solides, et il est toujours recommandé de les manipuler avec un soin extrême, en portant des gants et des lunettes de protection..
Les bases faibles forment une contrepartie conjuguée
Les bases faibles une fois dissoutes forment une contrepartie conjuguée, c'est-à-dire qu'une base faible forme un acide conjugué.
Par exemple, le tris- (hydroxyméthyl) amino méthane (OHCHdeux)3CNHdeux est une base faible dont l'acide conjugué est (OHCHdeux)3CNH3+:
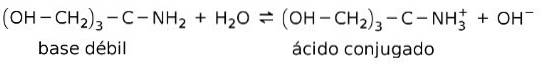
C'est la base de l'action des substances tampons ou amortir, qui sont des substances utilisées pour maintenir constamment le pH des solutions.
Vous voudrez peut-être connaître les différences entre les acides et les bases.


Personne n'a encore commenté ce post.