
Concept de charge nucléaire efficace, comment le calculer et exemples
La Charge nucléaire efficace (Zef) est la force d'attraction exercée par le noyau sur l'un des électrons après avoir été réduite par les effets de blindage et de pénétration. S'il n'y avait pas de tels effets, les électrons ressentiraient la force d'attraction de la charge nucléaire réelle Z.
Dans l'image ci-dessous, nous avons le modèle atomique de Bohr pour un atome fictif. Son noyau a une charge nucléaire Z = + n, qui attire les électrons qui gravitent autour de lui (les cercles bleus). On peut voir que deux électrons sont sur une orbite plus proche du noyau, tandis que le troisième électron se trouve à une plus grande distance de celui-ci..
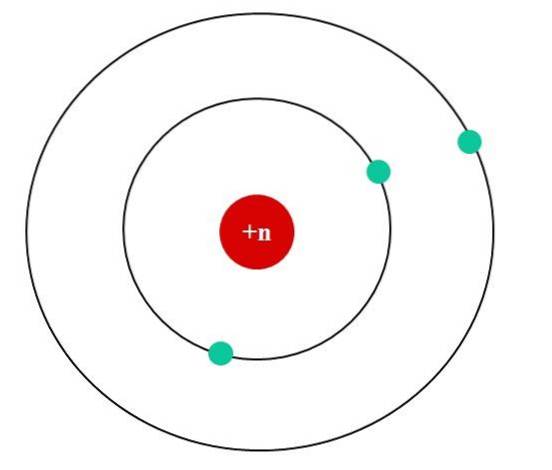
Le troisième électron orbite ressentant les répulsions électrostatiques des deux autres électrons, de sorte que le noyau l'attire avec moins de force; c'est-à-dire que l'interaction noyau-électron diminue en raison du blindage des deux premiers électrons.
Ainsi, les deux premiers électrons ressentent la force d'attraction d'une charge + n, mais le troisième subit une charge nucléaire effective de + (n-2) à la place..
Cependant, ledit Zef ne serait valide que si les distances (le rayon) au noyau de tous les électrons étaient toujours constantes et définies, localisant leurs charges négatives (-1).
Index des articles
- 1 Concept
- 1.1 Effets de pénétration et de protection
- 2 Comment le calculer?
- 2.1 La règle de Slater
- 3 exemples
- 3.1 Déterminer Zef pour les électrons dans l'orbitale 2s2 dans le béryllium
- 3.2 Déterminer Zef pour les électrons dans l'orbitale 3p3 du luminophore
- 4 Références
Concept
Les protons définissent les noyaux des éléments chimiques et les électrons définissent leur identité au sein d'un ensemble de caractéristiques (les groupes du tableau périodique)..
Les protons augmentent la charge nucléaire Z au taux de n + 1, ce qui est compensé par l'ajout d'un nouvel électron pour stabiliser l'atome.
Au fur et à mesure que le nombre de protons augmente, le noyau est «couvert» par un nuage dynamique d'électrons, dans lequel les régions à travers lesquelles ils circulent sont définies par les distributions de probabilité des parties radiale et angulaire des fonctions d'onde (les orbitales).
De cette approche, les électrons n'orbite pas dans une région définie de l'espace autour du noyau, mais plutôt, comme les pales d'un ventilateur à rotation rapide, ils se brouillent dans les formes des orbitales connues s, p, d et f.
Pour cette raison, la charge négative -1 d'un électron est distribuée par les régions que les orbitales pénètrent; plus l'effet de pénétration est important, plus la charge nucléaire effective que cet électron subira dans l'orbitale sera importante.
Effets de pénétration et de protection
Selon l'explication ci-dessus, les électrons dans les coques internes ne contribuent pas à une charge -1 à la répulsion stabilisatrice des électrons dans les coques externes..
Cependant, ce noyau (les coquilles précédemment remplies d'électrons) sert de «mur» qui empêche la force d'attraction du noyau d'atteindre les électrons extérieurs..
Ceci est connu sous le nom d'effet d'écran ou d'effet de blindage. De plus, tous les électrons des couches externes ne subissent pas la même ampleur de cet effet; par exemple, si vous occupez une orbitale qui a un caractère pénétrant élevé (c'est-à-dire qui transite très près du noyau et d'autres orbitales), alors vous ressentirez un Zef supérieur.
En conséquence, un ordre de stabilité énergétique apparaît en fonction de ces Zef pour les orbitales: s Cela signifie que l'orbitale 2p a une énergie plus élevée (moins stabilisée par la charge du noyau) que l'orbitale 2s.. Plus l'effet de pénétration exercé par l'orbitale est faible, moins son effet de blindage sur le reste des électrons externes sera faible. Les orbitales d et f montrent de nombreux trous (nœuds) où le noyau attire d'autres électrons. En supposant que les charges négatives sont localisées, la formule de calcul de Zef pour tout électron est: Zef = Z - σ Dans cette formule, σ est la constante de blindage déterminée par les électrons du noyau. En effet, théoriquement, les électrons les plus externes ne contribuent pas au blindage des électrons internes. En d'autres termes, 1sdeux bouclier électron 2s1, mais 2s1 ne protège pas les électrons Z 1sdeux. Si Z = 40, en négligeant les effets mentionnés, alors le dernier électron subira un Zef égal à 1 (40-39). La règle de Slater est une bonne approximation des valeurs Zef pour les électrons de l'atome. Pour l'appliquer, suivez les étapes ci-dessous: 1- La configuration électronique de l'atome (ou de l'ion) doit s'écrire comme suit: (1s) (2s 2p) (3s 3p) (3d) (4s 4p) (4d) (4f)… 2- Les électrons qui se trouvent à droite de celui considéré ne contribuent pas à l'effet de blindage. 3- Les électrons qui sont dans le même groupe (marqués par les parenthèses) fournissent 0,35 la charge de l'électron sauf s'il s'agit du groupe 1s, soit 0,30 à la place. 4- Si l'électron occupe une orbitale s ou p, alors toutes les orbitales n-1 contribuent 0,85, et toutes les orbitales n-2 une unité. 5- Dans le cas où l'électron occupe une orbitale d ou f, tous ceux à sa gauche contribuent une unité. Suivant le mode de représentation de Slater, la configuration électronique de Be (Z = 4) est: (1 sdeux) (2sdeux2 P0) Puisqu'il y a deux électrons dans l'orbitale, l'un d'eux contribue au blindage de l'autre, et l'orbitale 1s est le n-1 de l'orbitale 2s. Ensuite, en développant la somme algébrique, nous avons ce qui suit: (0,35) (1) + (0,85) (2) = 2,05 Le 0,35 provenait de l'électron 2s et le 0,85 des deux électrons 1s. Maintenant, en appliquant la formule de Zef: Zef = 4 - 2,05 = 1,95 Qu'est ce que ça signifie? Cela signifie que les électrons dans l'orbitale 2sdeux subissez une charge de +1,95 qui les attire vers le cœur, plutôt que la charge réelle de +4. Encore une fois, cela continue comme dans l'exemple précédent: (1 sdeux) (2sdeux2 P6) (3sdeux3p3) Maintenant, la somme algébrique est développée pour déterminer σ: (, 35) (4) + (0,85) (8) + (1) (2) = 10,2 Donc, Zef est la différence entre σ et Z: Zef = 15-10,2 = 4,8 En conclusion, les 3 derniers électrons3 ils subissent une charge trois fois inférieure à la vraie. Il faut également noter que, selon cette règle, les électrons 3sdeux éprouver le même Zef, un résultat qui pourrait soulever des doutes à ce sujet. Cependant, il existe des modifications de la règle de Slater qui aident à approximer les valeurs calculées des valeurs réelles..Comment le calculer?
La règle de Slater
Exemples
Déterminer Zef pour les électrons dans l'orbitale 2sdeux en béryllium
Déterminer Zef pour les électrons dans l'orbitale 3p3 de phosphore
Les références


Personne n'a encore commenté ce post.