
Structure, propriétés et utilisations du cyclopentane (C5H10)
le cyclopentane c'est un hydrocarbure cyclique, plus précisément un cycloalcane. À son tour, c'est un composé organique dont la formule moléculaire est C5Hdix. Il peut être considéré comme la version fermée du n-pentane, chaîne ouverte, dans laquelle ses extrémités ont été jointes par la perte de deux atomes d'hydrogène.
L'image du bas montre le squelette du cyclopentane. Remarquez à quel point son squelette est géométrique, formant un anneau pentagonal. Cependant, sa structure moléculaire n'est pas plate, mais présente plutôt des plis qui cherchent à stabiliser et à réduire la contrainte à l'intérieur de l'anneau. Le cyclopentane est un liquide hautement volatil et inflammable, mais pas aussi inflammable que n-pentane.
En raison de sa capacité de solvant, le cyclopentane est l'un des solvants les plus utilisés dans les industries chimiques. Il n'est pas surprenant que de nombreux produits à forte odeur en contiennent dans leur composition, étant donc inflammable. Il est également utilisé comme agent gonflant pour les mousses de polyuréthane utilisées dans les réfrigérateurs..
Index des articles
- 1 Structure du cyclipentane
- 1.1 Interactions intermoléculaires
- 1.2 Conformations et contrainte annulaire
- 2 Propriétés du cyclipentane
- 2.1 Apparence physique
- 2.2 Masse molaire
- 2.3 Point de fusion
- 2.4 Point d'ébullition
- 2.5 Point d'éclair
- 2.6 Température d'auto-inflammation
- 2.7 Chaleur de vaporisation
- 2.8 Viscosité
- 2.9 Indice de réfraction
- 2.10 Pression de vapeur
- 2.11 Densité
- 2.12 Solubilité
- 2.13 Coefficient de partage octanol / eau
- 2.14 Réactivité
- 3 utilisations
- 3.1 Solvant industriel
- 3.2 Source d'éthylène
- 3.3 Mousses isolantes de polyuréthane
- 4 Références
Structure du cyclipentane
Interactions intermoléculaires
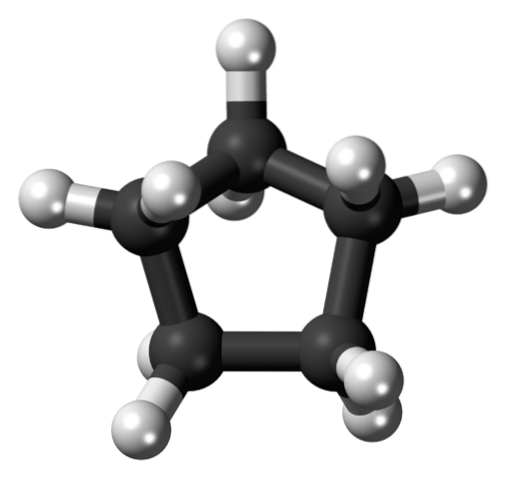
Dans la première image, le squelette du cyclopentane a été montré. Ci-dessus, nous voyons maintenant que c'est plus qu'un simple pentagone: des atomes d'hydrogène (sphères blanches) font saillie sur ses bords, tandis que les atomes de carbone composent l'anneau pentagonal (sphères noires).
En n'ayant que des liaisons C-C et C-H, leur moment dipolaire est négligeable, de sorte que les molécules de cyclopentane ne peuvent pas interagir entre elles par des forces dipôle-dipôle. Au lieu de cela, ils sont maintenus ensemble grâce aux forces dispersives de Londres, les anneaux tentant de s'empiler les uns sur les autres..
Cet empilement offre une surface de contact supérieure à celle disponible entre les molécules linéaires de n-pentane. En conséquence, le cyclopentane a un point d'ébullition plus élevé que n-pentane, ainsi qu'une pression de vapeur plus faible.
Les forces de dispersion sont responsables de la formation d'un cristal moléculaire par le cyclopentane lorsqu'il est congelé à -94 ºC. Bien qu'il n'y ait pas beaucoup d'informations concernant sa structure cristalline, il est polymorphe et comporte trois phases: I, II et III, la phase II étant un mélange désordonné de I et III.
Conformations et contrainte annulaire
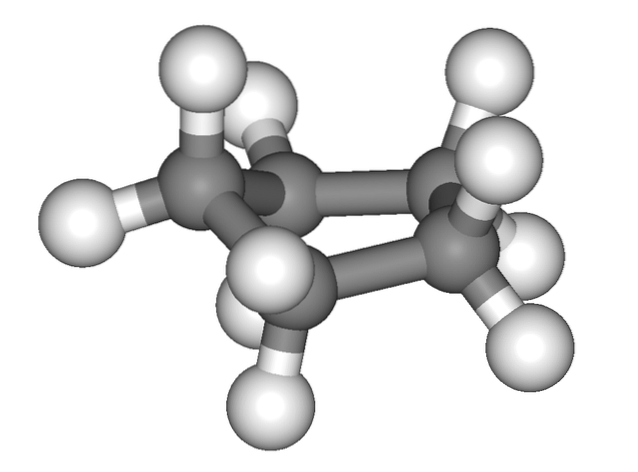
L'image ci-dessus donne la fausse impression que le cyclopentane est plat; mais ce n'est pas comme ça. Tous ses atomes de carbone ont une hybridation sp3, donc leurs orbitales ne sont pas dans le même plan. Aussi, comme si cela ne suffisait pas, les atomes d'hydrogène sont très proches les uns des autres, fortement repoussés lorsqu'ils sont éclipsés..
Ainsi, on parle de conformations, l'une d'elles étant la demi-chaise (image du haut). De ce point de vue, il est clairement apprécié que le cycle cyclopentane présente des coudes, qui contribuent à réduire sa tension cyclique en raison de ses atomes de carbone si proches les uns des autres..
Cette tension est due au fait que les liaisons C-C présentent des angles inférieurs à 109,5 °, valeur idéale pour l'environnement tétraédrique du fait de leurs hybridations sp.3.
Cependant, malgré ce stress, le cyclopentane est un composé plus stable et moins inflammable que le pentane. Cela peut être vérifié en comparant leurs diamants de sécurité, dans lesquels l'inflammabilité du cyclopentane est de 3, tandis que celle du pentane, 4.
Propriétés du cyclipentane
Apparence physique
Liquide incolore avec une légère odeur de pétrole.
Masse molaire
70,1 g / mol
Point de fusion
-93,9 ºC
Point d'ébullition
49,2 ºC
point de rupture
-37,2 ºC
La température d'auto-inflammation
361 ºC
Chaleur de vaporisation
28,52 kJ / mol à 25 ºC
Viscosité
0,413 mPa s
Indice de réfraction
1 4065
La pression de vapeur
45 kPa à 20 ° C Cette pression correspond à environ 440 atm, cependant inférieure à celle du n-Pentane: 57,90 kPa.
Ici, l'effet de la structure se manifeste: le cycle cyclopentane permet des interactions intermoléculaires plus efficaces, qui se lie et retient plus ses molécules dans le liquide par rapport aux molécules linéaires du n-pentane. Par conséquent, ce dernier a une pression de vapeur plus élevée.
Densité
0,751 g / cm3 à 20 ° C En revanche, ses vapeurs sont 2,42 fois plus denses que l'air.
Solubilité
Dans un litre d'eau à 25 ° C, seulement 156 mg de cyclopentane se dissout, en raison de sa nature hydrophobe. Cependant, il est miscible dans des solvants non polaires tels que d'autres paraffines, éthers, benzène, tétrachlorure de carbone, acétone et éthanol..
Coefficient de partage octanol / eau
3
Réactivité
Le cyclopentane est stable lorsqu'il est stocké correctement. Ce n'est pas une substance réactive car ses liaisons C-H et C-C ne sont pas faciles à rompre, même si cela conduirait à la libération d'énergie provoquée par la tension de l'anneau.
En présence d'oxygène, il brûlera lors d'une réaction de combustion, qu'elle soit complète ou incomplète. Le cyclopentane étant un composé très volatil, il doit être stocké dans des endroits où il ne peut être exposé à aucune source de chaleur..
Pendant ce temps, en l'absence d'oxygène, le cyclopentane subira une réaction de pyrolyse, se décomposant en molécules plus petites et insaturées. L'un d'eux est le 1-pentène, ce qui montre que la chaleur rompt le cycle cyclopentane pour produire un alcène.
D'autre part, le cyclopentane peut réagir avec le brome sous un rayonnement ultraviolet. De cette manière, l'une de ses liaisons C-H est remplacée par C-Br, qui à son tour peut être remplacée par d'autres groupes; et ainsi, des dérivés de cyclopentane émergent.
Applications
Solvant industriel
Le caractère hydrophobe et apolaire du cyclopentane en fait un solvant dégraissant, avec d'autres solvants paraffiniques. Pour cette raison, il fait généralement partie des formulations de nombreux produits, tels que les colles, les résines synthétiques, les peintures, les adhésifs, le tabac et l'essence..
Source d'éthylène
Lorsque le cyclopentane est soumis à la pyrolyse, l'une des substances les plus importantes qu'il génère est l'éthylène, qui a d'innombrables applications dans le monde des polymères..
Mousses isolantes de polyuréthane
L'une des utilisations les plus notables du cyclopentane est comme agent gonflant pour la fabrication de mousses isolantes de polyuréthane; c'est-à-dire que les vapeurs de cyclopentane, en raison de leur haute pression, dilatent le matériau polymère jusqu'à ce qu'il forme une mousse aux propriétés avantageuses à utiliser dans le cadre de réfrigérateurs ou de congélateurs.
Certaines entreprises ont choisi de remplacer les HFC par le cyclopentane dans la fabrication de matériaux isolants, car ils ne contribuent pas à la détérioration de la couche d'ozone et réduisent également les rejets de gaz à effet de serre dans l'environnement..
Les références
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organique. (dixe édition.). Wiley plus.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Wikipédia. (2020). Cyclopentane. Récupéré de: en.wikipedia.org
- Centre national d'information sur la biotechnologie. (2020). Cyclopentane. Base de données PubChem, CID = 9253. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Elsevier B.V. (2020). Cyclopentane. ScienceDirect. Récupéré de: sciencedirect.com
- Appareils électroménagers GE. (2011, 11 janvier). Réduire les émissions de gaz à effet de serre dans les installations de fabrication de réfrigérateurs de GE. Récupéré de: pressroom.geappliances.com



Personne n'a encore commenté ce post.