
Propriétés, risques et utilisations de l'acide arsénieux (H3AsO3)
le acide arsénieux c'est un composé inorganique de formule H3AsO3. Sa structure est analogue à la trihydroxyamine et peut être réécrite comme As (OH) 3. Il se présente sous forme aqueuse et il n'a pas été possible de l'isoler à l'état solide pur. Sa structure est présentée dans la figure 1.
L'élaboration d'As (OH) 3 entraîne une hydrolyse lente du trioxyde d'arsenic dans l'eau. La somme de la base convertit l'acide arsénique en ions arsénite: [AsO (OH) 2] -, [AsO2 (OH)] 2- et [AsO3] 3-.
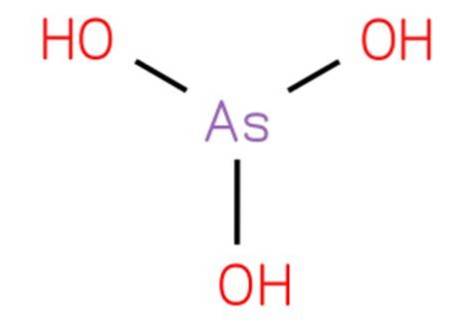
C'est un acide faible. Les réactions attribuées au trioxyde d'arsenic aqueux sont dues à l'acide arsénique et à ses bases conjuguées.
Index des articles
- 1 Propriétés physiques et chimiques de l'acide arsénieux
- 2 Réactivité et dangers
- 2.1 En cas de contact avec les yeux
- 2.2 En cas de contact cutané
- 2.3 En cas d'ingestion
- 2.4 En cas d'inhalation
- 3 utilisations
- 4 Références
Propriétés physiques et chimiques de l'acide arsénieux
L'acide arséneux est une molécule pyramidale constituée de trois groupes hydroxyle liés à l'arsenic. Le spectre RMN 1H des solutions d'acide arsénique consiste en un seul signal compatible avec la symétrie élevée de la molécule. Existe uniquement en solution aqueuse.
Cette solution est incolore et n'a pas d'arôme caractéristique. Il est stocké dans des conteneurs orange pour éviter toute réaction avec les rayons UV (National Center for Biotechnology Information, 2017).

Son poids moléculaire est de 125,94 g / mol. Bien que le composé n'ait pas été isolé, ses propriétés ont été calculées à l'aide de méthodes de calcul (© Royal Society of Chemistry, 2015) obtenant qu'il a un point de fusion de 271,52 ° C, un point d'ébullition de 626,14 ° C et une solubilité dans l'eau de 1 x 106 mg / l à 25 ° C.
Le composé a un pKa de 9,2 pour la réaction:
H3AsO3 ⇌ H2AsO3- + H+
La littérature rapporte que le composé a un caractère amphotère, bien qu'il se dissocie en tant que base à un degré moindre qu'il ne se dissocie en tant qu'acide, la base ayant un pKb de 14 pour la réaction:
Comme (OH) 3 ⇌ Comme (OH) 2+ + OH-
Cela conduit à la formation d'espèces telles que les sulfates d'hydroxyde d'arsenic acides (As (OH) (HSO4) +, As (OH) 2 (HSO4)) dans des solutions concentrées d'acide sulfurique ou à la formation de sulfate d'acide d'arsenic (As (HSO4)) ) 3) dans des solutions d'acide sulfurique fumant.
L'acide arsénique peut jouer le rôle d'agent oxydant ou d'agent réducteur, restant respectivement sous forme d'arsenic élémentaire ou d'acide arsenic selon les demi-réactions:
H3AsO3 + 3H + + 3e- → Comme + 3 H2O (ξ0 = +0,240 V)
H3AsO3 + H2O → H3AsO4 + 2H + + 2e- (ξ0 = -0,560 V)
L'acide arsénieux est un agent oxydant plus puissant que son homologue phosphonique, mais un agent réducteur plus faible que lui (Egon Wiberg, 2001).
Réactivité et dangers
L'acide arséneux est un composé classé comme stable, mais c'est un réactif toxique et corrosif.
Le composé présente un risque d'incendie et d'explosion négligeable lorsqu'il est exposé à la chaleur ou aux flammes. Dans ce cas, le conteneur doit être déplacé si possible, éviter de respirer les vapeurs ou la poussière..
Lorsqu'il est chauffé, le composé libère des fumées d'oxyde d'arsenic toxiques et corrosives. Un appareil respiratoire autonome et des vêtements de protection doivent être portés pour éviter tout contact en cas d'incendie.
Il peut être irritant pour les yeux, la peau et les muqueuses. Peut provoquer une sensibilisation. L'empoisonnement peut affecter les systèmes nerveux central, gastro-intestinal et cardiovasculaire, le foie et les reins. Les composés contenant de l'arsenic sont hautement toxiques et cancérigènes.
En cas de contact avec les yeux
Laver abondamment à l'eau pendant au moins 15 minutes, en soulevant de temps en temps les paupières jusqu'à ce qu'il n'y ait plus de traces de résidus chimiques.
En cas de contact cutané
Se laver immédiatement et abondamment à l'eau et au savon pendant au moins 15 minutes tout en retirant les vêtements et chaussures contaminés. Les brûlures sont recouvertes d'un pansement stérile sec (sécurisé, non étanche).
En cas d'ingestion
De grandes quantités d'eau doivent être données à la victime consciente pour diluer l'acide. N'utilisez pas de lavage gastrique et ne faites pas vomir. Le personnel médical doit maintenir les voies respiratoires et la respiration.
En cas d'inhalation
La respiration artificielle doit être pratiquée si nécessaire. Déplacer la victime dans un endroit frais et la garder au chaud et au repos.
Dans tous les cas, une attention médicale immédiate doit être recherchée (Fiche de données de sécurité Arsenious acid solution, 2007).
Applications
L'acide arsénieux est utilisé pour détecter de petites quantités d'iode ou de composés d'iode. Dans les travaux de (Weegh, 1972), certains aspects de la réaction cérique de l'acide arsénique ont été étudiés, en accordant une attention particulière aux propriétés optiques des solutions cériques..
Les effets cinétiques de divers composés ont également été étudiés, en particulier les effets des ions chlorure et bromure et les effets cinétiques du chlorure ou du bromure en combinaison avec l'iodure..
L'acide arsénique peut également être utilisé de manière illicite pour provoquer des avortements (Trend, 1858).
L'acide arséneux réagit lorsqu'il est chauffé pour former du trioxyde d'arsenic (As2O3). Ce composé est également connu sous le nom d'acide arsénique bien qu'il ne soit pas le même composé. La structure du trioxyde d'arsenic est présentée dans la figure 3.
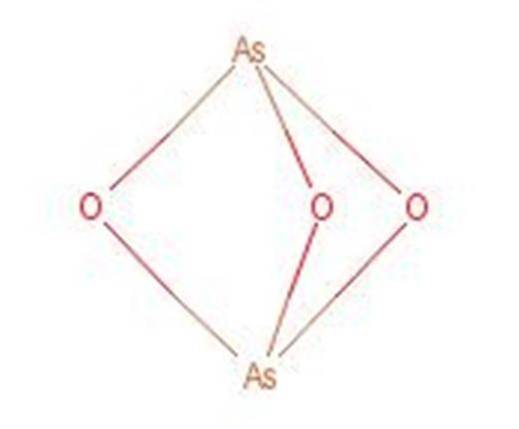
Figure 1: Structure du trioxyde d'arsenic.
Ce composé, également connu sous le nom de Trisenox, est utilisé pour traiter les patients atteints de leucémie qui n'ont pas répondu à d'autres agents. Ce médicament est approuvé pour une utilisation par la Food and Drug Administration (FDA) des États-Unis en tant que traitement de la leucémie..
Le fonctionnement du composé n'est pas clair. Il peut provoquer des changements morphologiques et une fragmentation de l'ADN dans les cellules de leucémie promyélocytaire, entraînant la mort cellulaire et la dégradation ou l'endommagement de la PML / RAR alpha (une protéine de fusion) (Nurse's Drug Handbook 7th Ed, 2013).
Étant toxique pour le corps humain, c'est l'une des drogues les plus discutables sur le terrain. Le trioxyde d'arsenic a été utilisé pour la première fois comme médicament traditionnel chinois appelé Pi Shuang. Il est encore utilisé aujourd'hui pour traiter les patients atteints de cancer et d'autres problèmes de santé. (Analyse de l'acide arsénieux, 2007-2016).
Les références
- © Société royale de chimie. (2015). Acide arsénique. Récupéré de chemspider.
- © Société royale de chimie. (2015). Trihydroxyamine. Récupéré de chemspider.
- Examen de l'acide arsénieux. (2007-2016). Récupéré de medicalook.
- Acide arsénique. (2014, 28 juillet). Récupéré de ebi.ac.uk.
- Egon Wiberg, N. W. (2001). Chimie inorganique. Berlin: presse académique.
- Fiche signalétique Solution d'acide arsénieux. (2007, 10 septembre). Récupéré de t3db.ca.
- Centre national d'information sur la biotechnologie. (2017, 4 mars). Base de données des composés PubChem; CID = 545,. Récupéré de PubChem.
- Nurse's Drug Handbook, 7e édition (2013). McGraw-Hill.
- Tendance, H. G. (1858). Un cas dans lequel l'acide arsénieux a été utilisé pour provoquer un avortement. comunications originales du journal médical britannique, 725-726.
- Weegh, W. H. (1972). Utilisation de la réaction d'acide arsénieux cérique pour la détermination de petites quantités d'iode ou de composés d'iode. Clinica Chimica Acta Volume 39, Numéro 2, 327-338.



Personne n'a encore commenté ce post.