
Structure chimique de l'acide borique, propriétés, préparation, utilisations
le acide borique est un composé inorganique dont la formule chimique est H3BO3. Il se compose d'un solide blanc ou incolore. C'est un acide faible qui en solution aqueuse produit, selon sa concentration, un pH compris entre 3,8 et 4,8. Il est peu soluble dans l'eau froide et modérément soluble dans l'eau chaude..
L'acide borique a été découvert en 1702 par Wilhelm Homberg (1652-1713), qui a traité le borax avec de l'acide sulfurique, obtenant une solution à action médicinale qui a reçu le nom d'eau sédative d'Homberg..

Cependant, il est également souligné que Homberg a préparé l'acide borique en ajoutant de l'eau au borax et en chauffant la solution jusqu'à ce qu'elle s'évapore, laissant ainsi les cristaux d'acide borique dans le sédiment..
Cet acide est un composé très utile qui a de nombreuses applications dans l'industrie et la médecine, étant également utilisé comme insecticide, préservation du bois, ignifuge et est un constituant d'une solution tampon de pH..
Index des articles
- 1 Structure chimique
- 1.1 Cristaux
- 2 propriétés
- 2.1 Noms
- 2.2 Masse molaire
- 2.3 Apparence physique
- 2.4 Odeur
- 2.5 Saveur
- 2.6 Point de fusion
- 2.7 Point d'ébullition
- 2.8 Solubilité dans l'eau
- 2.9 Solubilité dans d'autres solvants
- 2.10 Coefficient de partage octanol / eau
- 2.11 Acidité (pKa)
- 2,12 pH
- 2.13 Pression de vapeur
- 2.14 Stabilité
- 2.15 Décomposition
- 2.16 Réactivité
- 3 Préparation
- 4 utilisations
- 4.1 Dans l'industrie
- 4.2 En médecine
- 4.3 Insecticide
- 4.4 Conservation
- 4,5 pH tampon
- 4.6 Réacteurs nucléaires
- 4.7 Agriculture
- 5 Contre-indications
- 6 Références
Structure chimique
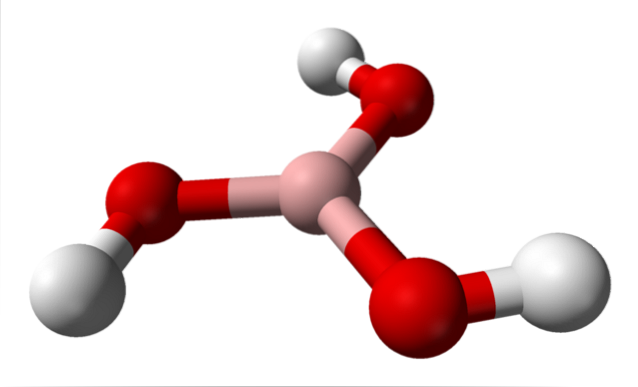
Dans l'image supérieure, nous avons la molécule elle-même de H3BO3. Notez que les atomes d'hydrogène, représentés par des sphères blanches, ne sont pas liés à l'atome central de bore, comme la formule chimique pourrait le suggérer; mais plutôt aux atomes d'oxygène, représentés par des sphères rouges.
Ainsi, une formule plus pratique, bien que moins utilisée, pour l'acide borique est B (OH)3, indiquant que son acidité est due aux ions H+ libérés de leurs groupes OH. La molécule B (OH)3 a une géométrie plane trigonale, avec son atome de bore ayant une hybridation chimique spdeux.
Le B (OH)3 C'est une molécule hautement covalente, car la différence d'électronégativité entre l'atome de bore et l'oxygène n'est pas très grande; les liaisons B-O sont donc essentiellement covalentes. A noter également que la structure de cette molécule ressemble à celle d'un spinner. Peut-il tourner sur son propre axe de la même manière?
Cristaux
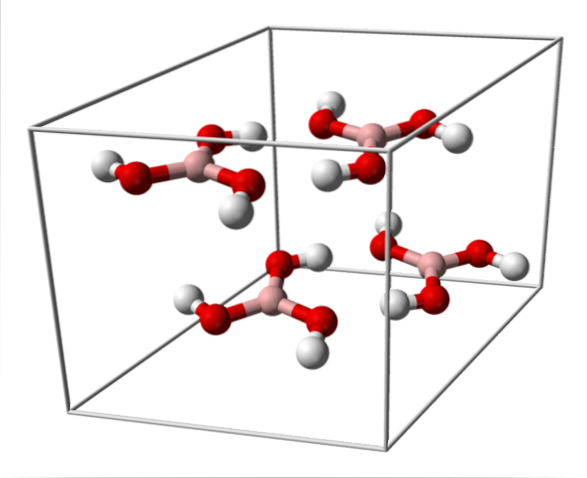
L'image du haut montre la maille élémentaire correspondant à la structure cristalline triclinique de l'acide borique qui, dans certaines conditions de synthèse, peut adopter la structure hexagonale compacte. Notez qu'il y a quatre molécules par maille élémentaire, et qu'elles sont disposées en deux couches, A et B, en alternance (elles ne se superposent pas l'une sur l'autre).
En raison de la symétrie et de l'orientation des liaisons B-OH, on peut supposer que le B (OH)3 est apolaire; cependant, l'existence de liaisons hydrogène intermoléculaires change la donne. Chaque molécule de B (OH)3 de donner ou de recevoir trois de ces ponts, avec un total de six interactions dipôle-dipôle, comme observé dans l'image ci-dessous:
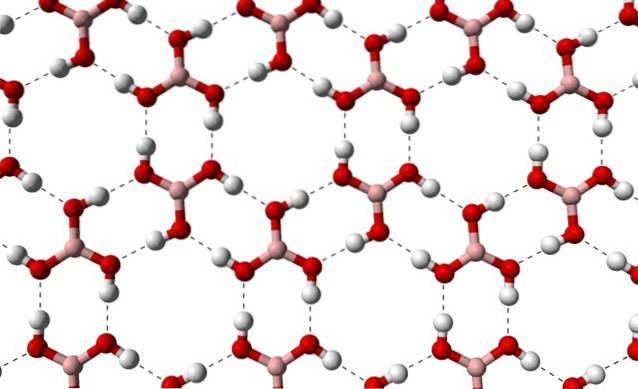
Notez que ces liaisons hydrogène sont les interactions directionnelles qui régissent les cristaux d'acide borique et établissent des modèles d'aspects ornementaux; anneaux intérieurs peut-être avec suffisamment d'espace pour occlure certaines impuretés qui ne sont pas dans les défauts du cristal.
Ces liaisons hydrogène, malgré la faible masse moléculaire de B (OH)3, ils gardent leur verre suffisamment cohésif pour qu'il ait besoin d'une température de 171 ° C pour fondre. On ne sait pas quels effets des pressions élevées (de l'ordre du GPa) auraient sur les couches moléculaires de B (OH)3.
Propriétés
Des noms
IUPAC: acide borique et trihydrooxyde borique. Autres noms: acide orthoborique, acide boracique, sassolite, borofax et trihydroxyborane.
Masse molaire
61,83 g / mol
Apparence physique
Solide blanc cristallin clair, incolore. Il est également disponible sous forme de granulés ou de poudre blanche. Légèrement crémeux au toucher.
Odeur
Toilette
Goût
Légèrement amer
Point de fusion
170,9 ºC
Point d'ébullition
300 ºC
Solubilité dans l'eau
Modérément soluble dans l'eau froide et soluble dans l'eau chaude:
2,52 g / 100 ml (0 ºC)
27,50 g / 100 ml (100 ºC)
L'acide borique est partiellement soluble dans l'eau et a tendance à s'y enfoncer. Cette solubilité a tendance à augmenter en présence d'acides, tels que chlorhydrique, citrique et tartrique..
Solubilité dans d'autres solvants
-Glycérol: 17,5% à 25 ºC
-Éthylène glycol: 18,5% à 25 ºC
-Acétone: 0,6% à 25 ºC
-Acétate d'éthyle: 1,5% à 25 ºC
-Méthanol: 172 g / L à 25 ºC
-Éthanol: 94,4 g / L à 25 ºC
Coefficient de partage octanol / eau
Log P = -0,29
Acidité (pKa)
9.24. 12.4. 13.3. Ce sont les trois constantes de leurs dissociations respectives pour libérer H+ dans l'eau.
pH
3,8 - 4,8 (3,3% en solution aqueuse)
5,1 (0,1 molaire)
La pression de vapeur
1,6 10-6 mmHg
Stabilité
Stable dans l'eau
Décomposition
Il se décompose lorsqu'il est chauffé au-dessus de 100 ° C, formant de l'anhydride borique et de l'eau.
Réactivité
L'acide borique forme des sels solubles avec des cations monovalents, par exemple: NadeuxB4OU ALORS7.10HdeuxO, et sels insolubles avec des cations divalents, CaB4OU ALORS7.6HdeuxOU ALORS.
En solution aqueuse, il produit une solution acide, pensant que cette propriété était due à la soustraction de groupes OH- de l'eau. L'acide borique est classé comme un acide faible de type Lewis.
L'acide borique réagit avec le glycérol et le mannitol, augmentant l'acidité du milieu aqueux. Le pKa est modifié de 9,2 à 5, en raison de la formation du chélate de bore-mannitol [BC6H8OU ALORSdeux(OH)deux]-, qui libère H+.
préparation
L'acide borique se trouve à l'état libre dans les émanations volcaniques dans des régions telles que la Toscane en Italie, les îles Lipari et dans l'état du Nevada, aux États-Unis. On le trouve également dans des minéraux tels que le borax, la boracite, l'lexite et la colémanite..
L'acide borique est préparé principalement par la réaction du borax minéral (tétraborate de sodium décahydraté) avec des acides minéraux, tels que l'acide chlorhydrique, l'acide sulfurique, etc..
N / AdeuxB4OU ALORS910HdeuxO + HCl => 4 H3BO3 + 2 NaCl + 5 HdeuxOU ALORS
Il est également préparé par hydrolyse du trihalogénure de bore et du diborane..
L'acide borique est préparé à partir de colémanite (CadeuxB6OU ALORSOnze6 heuresdeuxOU ALORS). La procédure consiste à traiter le minéral avec de l'acide sulfurique pour dissoudre les composés du bore.
Ensuite, la solution contenant de l'acide borique est séparée des fragments non dissous. La solution est traitée avec du sulfure d'hydrogène pour précipiter les impuretés d'arsenic et de fer. Le surnageant est refroidi pour produire un précipité d'acide borique et le séparer de la suspension..
Applications
Dans l'industrie
L'acide borique est utilisé dans la fabrication de la fibre de verre. En contribuant à réduire le point de fusion, il augmente la résistance et l'efficacité de la fibre de verre textile: un matériau utilisé pour renforcer le plastique utilisé dans les navires, les tuyaux industriels et les cartes de circuits informatiques..
L'acide borique participe à la fabrication du verre borosilicaté, ce qui permet d'obtenir un verre résistant aux changements de température, utilisable dans la cuisine des maisons, dans la verrerie des laboratoires, tubes fluorescents, fibres optiques, écrans LCD, etc..
Il est utilisé dans l'industrie métallurgique pour durcir et traiter les alliages d'acier, ainsi que pour favoriser le revêtement métallique des matériaux.
Il est utilisé comme composant chimique dans la fracturation hydraulique (fracturation hydraulique): une méthode utilisée dans l'extraction de pétrole et de gaz. L'acide borique agit comme un retardateur de feu dans les matières cellulosiques, plastiques et textiles qui sont imprégnées d'acide borique pour augmenter leur résistance au feu..
En médecine
L'acide borique est utilisé dilué dans un collyre. Les capsules de gélatine d'acide borique sont utilisées pour traiter les infections fongiques, en particulier Candida albicans. Il a également été utilisé dans le traitement de l'acné.
L'acide borique est saupoudré sur les chaussettes pour prévenir les infections du pied, comme le pied d'athlète. De même, des solutions contenant de l'acide borique sont utilisées dans le traitement de l'otite externe chez l'homme, ainsi que chez l'animal..
L'acide borique est ajouté aux bouteilles utilisées pour la collecte d'urine, ce qui empêche la contamination bactérienne avant d'être examiné dans les laboratoires de diagnostic..
Insecticide
L'acide borique est utilisé pour contrôler la prolifération des insectes, tels que les cafards, les termites, les fourmis, etc. Il ne tue pas instantanément les cafards, car il affecte d'abord leurs systèmes digestif et nerveux, en plus de détruire leur exosquelette.
L'acide borique exerce son action lentement, permettant aux insectes qui l'ont ingéré d'entrer en contact avec d'autres insectes, propageant ainsi l'empoisonnement..
Préservation
L'acide borique est utilisé pour empêcher l'attaque du bois par les champignons et les insectes, étant utilisé à cet effet en association avec l'éthylène glycol. Ce traitement est également efficace pour contrôler le limon et les algues..
Tampon PH
L'acide borique et sa base conjuguée forment un système tampon de pKa = 9,24, ce qui indique que ce tampon est le plus efficace à pH alcalin, ce qui n'est pas habituel chez les êtres vivants. Cependant, le tampon borate est utilisé dans la régulation du pH dans les piscines..
Réacteurs nucléaires
L'acide borique a la capacité de capter les neutrons thermiques, ce qui réduit la possibilité d'une fission nucléaire incontrôlée pouvant conduire à des accidents nucléaires..
agriculture
Le bore est un élément essentiel pour la croissance des plantes, ce qui a conduit à l'utilisation de l'acide borique pour l'apport de l'élément. Cependant, trop d'acide borique peut nuire aux plantes, en particulier aux agrumes..
Contre-indications
L'utilisation d'acide borique sur la peau dénudée, les plaies ou les brûlures qui permet son absorption doit être évitée. Il s'agit d'un composé toxique à l'intérieur du corps et dans certains cas, il peut provoquer des évanouissements, des convulsions, des spasmes, des tics du visage et une pression artérielle basse..
Le médecin doit être consulté pour l'utilisation de gélules vaginales d'acide borique chez la femme enceinte, car il a été indiqué que cela pourrait provoquer des déformations fœtales et une diminution du poids corporel de l'enfant à la naissance..
Le placement d'acide borique, utilisé comme insecticide, dans des endroits à la portée des enfants doit également être évité, car les enfants sont plus sensibles à l'action toxique de l'acide borique, établissant la dose mortelle en eux de 2000 à 3000 mg.
Les références
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2019). Acide borique. Récupéré de: en.wikipedia.org
- Centre national d'information sur la biotechnologie. (2019). Acide borique. Base de données PubChem. CID = 7628. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Les rédacteurs de l'Encyclopaedia Britannica. (28 mars 2019). Acide borique. Encyclopædia Britannica. Récupéré de: britannica.com
- Transporteur vibrant. (9 novembre 2018). Les utilisations cachées de l'acide borique dans votre vie quotidienne. Récupéré de: carriervibrating.com
- Centre national d'information sur les pesticides. (s.f.). Acide borique. Récupéré de: npic.orst.edu
- Redaction. (30 novembre 2017). Acide borique: propriétés et utilisations de ce composé chimique. Récupéré de: acidos.info
- Chlorure de sodium. (2019). Acide borique. Récupéré de: chlorurosodio.com
- Société espagnole de pharmacie hospitalière. (s.f.). Acide borique. [PDF]. Récupéré de: workgroups.sefh.es


Personne n'a encore commenté ce post.