
Structure, propriétés, utilisations et risques de l'acide fumarique

le l'acide fumarique ou l'acide trans-butènedioïque est un acide dicarboxylique faible qui intervient dans le cycle de Krebs (ou cycle de l'acide tricarboxylique) et dans le cycle de l'urée. Sa structure moléculaire est HOOCCH = CHCOOH, dont la formule moléculaire condensée est C4H4OU ALORS4. Les sels et esters de l'acide fumarique sont appelés fumarates.
Il est produit dans le cycle de Krebs à partir de succinate oxydé en fumarate par l'action de l'enzyme succinate déshydrogénase, en utilisant le FAD (Flavin Adenil Dinucléotide) comme coenzyme. Alors que FAD est réduit à FADHdeux. Par la suite, le fumarate est hydraté en L-malate par l'action de l'enzyme fumarase.
Dans le cycle de l'urée, l'arginosuccinate est converti en fumarate par l'action de l'enzyme arginosuccinate lyase. Le fumarate est converti en malate par la fumarase cytosolique.
L'acide fumarique peut être fabriqué à partir de glucose dans un processus médié par le champignon Rhizopus nigricans. L'acide fumarique peut également être obtenu par isomérisation calorique de l'acide maléique. Il peut également être synthétisé par oxydation du furfural avec du chlorate de sodium en présence de pentoxyde de vanadium..
L'acide fumarique a de nombreuses utilisations; comme additif alimentaire, la production de résine et dans le traitement de certaines maladies, telles que le psoriasis et la sclérose en plaques. Cependant, il présente de légers risques pour la santé qui doivent être pris en compte..
Index des articles
- 1 Structure chimique
- 1.1 Isomérie géométrique
- 2 Propriétés physiques et chimiques
- 2.1 Formule moléculaire
- 2.2 Poids moléculaire
- 2.3 Apparence physique
- 2.4 Odeur
- 2.5 Saveur
- 2.6 Point d'ébullition
- 2.7 Point de fusion
- 2.8 Point d'éclair
- 2.9 Solubilité dans l'eau
- 2.10 Solubilité dans d'autres liquides
- 2.11 Densité
- 2.12 Pression de vapeur
- 2.13 Stabilité
- 2.14 Auto-inflammation
- 2.15 Chaleur de combustion
- 2,16 pH
- 2.17 Décomposition
- 3 utilisations
- 3.1 Dans les aliments
- 3.2 Dans la production de résines
- 3.3 En médecine
- 4 risques
- 5 Références
Structure chimique
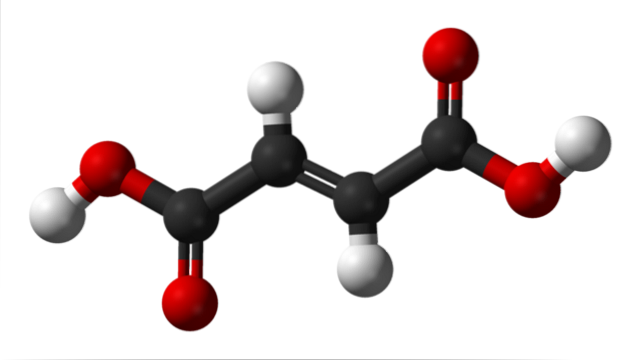
L'image du haut illustre la structure moléculaire de l'acide fumarique. Les sphères noires correspondent aux atomes de carbone qui composent son squelette hydrophobe, tandis que les sphères rouges appartiennent aux deux groupes carboxyliques COOH. Ainsi, les deux groupes COOH ne sont séparés que par deux carbones liés par une double liaison, C = C.
On peut dire que la structure de l'acide fumarique a une géométrie linéaire. C'est parce que tous les atomes de son squelette carbonate ont une hybridation spdeux et, par conséquent, ils reposent dans le même plan en plus des deux atomes d'hydrogène centraux (les deux sphères blanches, l'une tournée vers le haut et l'autre vers le bas).
Les deux seuls atomes qui dépassent de ce plan (et avec peu d'angles raides) sont les deux protons acides des groupes COOH (les sphères blanches sur les côtés). Lorsque l'acide fumarique est complètement déprotoné, il acquiert deux charges négatives qui résonnent à ses extrémités, devenant ainsi un anion dibasique..
Isomérie géométrique
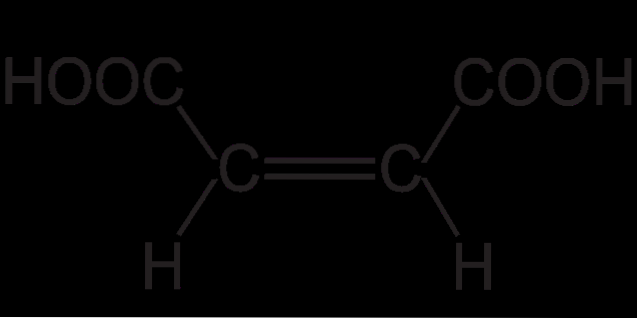
La structure de l'acide fumarique montre une isomérie trans (ou E). Cela réside dans les positions spatiales relatives des substituants sur la double liaison. Les deux petits atomes d'hydrogène pointent dans des directions opposées, tout comme les deux groupes COOH..
Cela donne à l'acide fumarique un squelette «en zigzag». Alors que pour son autre isomère géométrique, cis (ou Z), qui n'est rien de plus que de l'acide maléique, il présente un squelette courbe en forme de «C». Cette courbure est le résultat de la rencontre frontale des deux groupes COOH et des deux groupes H dans les mêmes orientations:
Proprietes physiques et chimiques
Formule moléculaire
C4H4OU ALORS4.
Poids moléculaire
116,072 g / mol.
Aspect physique
Un solide cristallin incolore. Les cristaux sont monocliniques en forme d'aiguille.
Poudre cristalline blanche ou granulés.
Odeur
Toilette.
Goût
Agrumes.
Point d'ébullition
329 ° F à une pression de 1,7 mmmHg (522 ° C). Sublime à 200 ° C (392 ° F) et se décompose à 287 ° C.
Point de fusion
572 ° F à 576 ° F (287 ° C).
point de rupture
273º C (verre ouvert). 230 ° C (tasse fermée).
Solubilité dans l'eau
7 000 mg / l à 25 ° C.
Solubilité dans d'autres liquides
-Soluble dans l'éthanol et dans l'acide sulfurique concentré. Avec l'éthanol, il peut former des liaisons hydrogène et, contrairement aux molécules d'eau, celles de l'éthanol interagissent avec une plus grande affinité avec le squelette organique de sa structure.
-Faiblement soluble dans l'ester éthylique et l'acétone.
Densité
1 635 g / cm3 à 68 ° F. 1,635 g / cm3 à 20º C.
La pression de vapeur
1,54 x 10-4 mmHg à 25 ° C.
Stabilité
Il est stable bien qu'il soit dégradable par les microorganismes aérobies et anaérobies.
Lorsque l'acide fumarique est chauffé dans un récipient fermé avec de l'eau entre 150 ° C et 170 ° C, il se forme de l'acide DL-malique..
Auto-inflammation
1 634 ° F (375 ° C).
Chaleur de combustion
2 760 cal / g.
pH
3,0-3,2 (solution à 0,05% à 25 ° C). Cette valeur dépend du degré de dissociation des deux protons, puisqu'il s'agit d'un acide dicarboxylique, donc diprotique..
Décomposition
Il se décompose en chauffant, produisant un gaz corrosif. Réagit violemment avec les oxydants forts, créant des gaz inflammables et toxiques qui pourraient provoquer un incendie et même des explosions.
En cas de combustion partielle, l'acide fumarique se transforme en anhydride maléique irritant..
Applications
Dans la nourriture
-Il est utilisé comme acidulant dans les aliments, remplissant une fonction régulatrice de l'acidité. Il peut également se substituer à l'acide tartrique et à l'acide citrique à cet effet. De plus, il est utilisé comme conservateur alimentaire.
-Dans l'industrie alimentaire, l'acide fumarique est utilisé comme agent acidifiant, appliqué sur les boissons gazeuses, les vins de style occidental, les boissons froides, les concentrés de jus de fruits, les fruits en conserve, les cornichons, les glaces et les boissons gazeuses..
-L'acide fumarique est utilisé dans les boissons de tous les jours, comme le lait au chocolat, le lait de poule, le cacao et le lait concentré. L'acide fumarique est également ajouté au fromage, y compris les fromages fondus et les succédanés de fromage..
-Les desserts tels que le pudding, le yogourt aromatisé et les sorbets peuvent contenir de l'acide fumarique. Cet acide peut conserver les œufs et les desserts à base d'œufs comme la crème anglaise..
Utilisations supplémentaires dans l'industrie alimentaire
-L'acide fumarique aide à stabiliser et aromatiser les aliments. Le bacon et les aliments en conserve ont également ce composé ajouté.
-Son utilisation combinée avec des benzoates et de l'acide borique est utile contre la dégradation de la viande, du poisson et des crustacés.
-Il a des propriétés antioxydantes, c'est pourquoi il a été utilisé dans la conservation du beurre, des fromages et du lait en poudre..
-Facilite la manipulation de la pâte de farine, lui permettant d'être travaillée plus facilement.
-Il a été utilisé avec succès dans l'alimentation des porcs en termes de prise de poids, d'amélioration de l'activité digestive et de réduction des bactéries pathogènes dans le système digestif.
Dans la production de résines
-L'acide fumarique est utilisé dans la production de résines polyester insaturées. Cette résine a une excellente résistance à la corrosion chimique et à la chaleur. De plus, il est utilisé dans la fabrication de résines alkydes, de résines phénoliques et d'élastomères (caoutchoucs).
-Le copolymère d'acide fumarique / acétate de vinyle est une forme d'adhésif de haute qualité. Le copolymère d'acide fumarique avec le styrène est une matière première dans la fabrication de fibres de verre.
-Il a été utilisé pour la production d'alcools polyhydriques et comme mordant de colorants.
En médecine
-Le fumarate de sodium peut réagir avec le sulfate ferreux pour former le gel de fumarate de fer, donnant naissance au médicament sous le nom de Fersamal. Ceci est également utilisé dans le traitement de l'anémie chez les enfants.
-L'ester de diméthylfumarate a été utilisé dans le traitement de la sclérose en plaques, produisant ainsi une réduction de la progression de l'invalidité.
-Divers esters d'acide fumarique ont été utilisés dans le traitement du psoriasis. Les composés d'acide fumarique exercent leur action thérapeutique grâce à leur capacité immunomodulatrice et immunosuppressive..
-La plante Fumaria officinalis contient naturellement de l'acide fumarique et est utilisée depuis des décennies dans le traitement du psoriasis.
Cependant, une insuffisance rénale, une insuffisance hépatique, des effets gastro-intestinaux et des bouffées vasomotrices ont été observés chez un patient traité par l'acide fumarique pour le psoriasis. Le trouble a été diagnostiqué comme une nécrosie tubulaire aiguë.
Expériences avec ce composé
-Dans une expérience chez l'homme ayant reçu 8 mg d'acide fumarique / jour pendant un an, aucun des participants n'a montré de lésions hépatiques..
-L'acide fumarique a été utilisé pour inhiber les tumeurs hépatiques induites par le thiocétamide chez la souris..
-Il a été utilisé chez des souris traitées avec la mitomycine C. Ce médicament provoque des anomalies hépatiques, consistant en divers changements cytologiques, tels qu'une irrégularité périnucléaire, une agrégation de chromatine et des organites cytoplasmiques anormaux. L'acide fumarique réduit également l'incidence de ces changements.
-Dans des expériences sur des rats, l'acide fumarique a montré une capacité inhibitrice du développement du papillome œsophagien, du gliome cérébral et des tumeurs mésenchymateuses du rein..
-Il existe des expériences qui montrent un effet opposé de l'acide fumarique par rapport aux tumeurs cancéreuses. Il a récemment été identifié comme un oncométabolite ou un métabolite endogène capable de provoquer le cancer. Il y a des niveaux élevés d'acide fumarique dans les tumeurs et dans le liquide autour de la tumeur.
Des risques
-Au contact des yeux, la poudre d'acide fumarique peut provoquer une irritation, se manifestant par des rougeurs, des larmoiements et des douleurs.
-Au contact de la peau, il peut provoquer des irritations et des rougeurs.
-L'inhalation peut irriter la membrane muqueuse des voies nasales, du larynx et de la gorge. Cela peut également provoquer de la toux ou un essoufflement..
-D'autre part, l'acide fumarique ne présente pas de toxicité lorsqu'il est ingéré..
Les références
- Steven A. Hardinger. (2017). Glossaire illustré de chimie organique: acide fumarique. Tiré de: chem.ucla.edu
- Groupe Transmerquim. (Août 2014). L'acide fumarique. [PDF]. Tiré de: gtm.net
- Wikipédia. (2018). L'acide fumarique. Tiré de: en.wikipedia.org/wiki/Fumaric_acid
- PubChem. (2018). L'acide fumarique. Tiré de: pubchem.ncbi.nlm.nih.gov
- Société royale de chimie. (2015). L'acide fumarique. Tiré de: chemspider.com
- ChemicalBook. (2017). L'acide fumarique. Tiré de: Chemicalbook.com



Personne n'a encore commenté ce post.