
Structure, fonctions et maladies de l'acide sialique
Les acides sialiques ce sont des monosaccharides de neuf atomes de carbone. Ils appartiennent à la famille des dérivés de l'acide neuraminique (acide 5-amino-3,5-didésoxy-D-glycéro-D-galacto-nonulosonique) et sont largement répandus dans la nature, en particulier dans le règne animal..
Ils ne se présentent normalement pas sous forme de molécules libres, mais sont liés par des liaisons α-glucosidiques à des molécules de glucides ou à d'autres molécules d'acide sialique, et peuvent alors occuper des positions terminales ou internes au sein d'une chaîne glucidique linéaire..
Le terme «acide sialique» a été inventé pour la première fois par Gunnar Blix en 1957, bien que des rapports antérieurs d'autres chercheurs indiquent que sa découverte remonte à une décennie ou deux plus tôt, lorsqu'ils ont été décrits comme faisant partie des glycoprotéines sialo mucine et des singolipides sialo sialo sialo (gangliosides ).
Les acides sialiques sont présents dans la plupart des règnes de la nature. Ils ont été détectés dans certains virus, bactéries pathogènes, protozoaires, crustacés, vers plats, insectes et vertébrés tels que poissons, amphibiens, oiseaux et mammifères. Au contraire, ils n'ont pas été trouvés dans les champignons, les algues ou les plantes..
Index des articles
- 1 Structure
- 2 fonctions
- 2.1 Rôle dans les processus d'adhésion cellulaire
- 2.2 Rôle dans la durée de vie des composants des cellules sanguines
- 2.3 Rôles dans le système immunitaire
- 2.4 Autres fonctions
- 3 Maladies
- 4 Références
Structure
Les acides sialiques se trouvent principalement dans la partie terminale des glycoprotéines de surface et des glycolipides, fournissant une grande diversité à ces glycoconjugués. Les modèles de "sialylation" différentiels sont des produits de l'expression de glycosyltransférases spécifiques aux tissus (sialyltransférases).
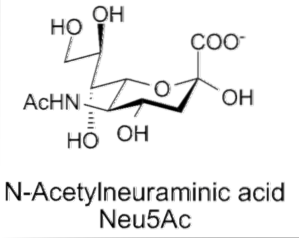
Structurellement, les acides sialiques appartiennent à une famille d'environ 40 dérivés naturels de l'acide neuraminique qui sont N-acylés, donnant naissance à deux structures «parentes»: l'acide N-acétylneuraminique (Neu5Ac) ou l'acide N-glycolyl neuraminique (Neu5Gc).
Ses caractéristiques structurelles comprennent la présence d'un groupe amino (qui peut être modifié) en position 5, et d'un groupe carboxylique en position 1, qui peut être ionisé à pH physiologique. Un carbone C-3 désoxygéné et une molécule de glycérol en position C-6.
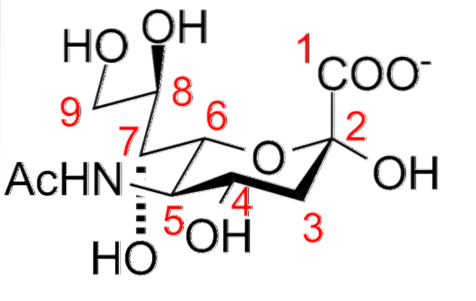
De nombreux dérivés proviennent de la substitution des groupes hydroxyle aux positions C-4, C-7, C-8 et C-9 par des portions acétyle, glycol, lactyle, méthyle, sulfate et phosphate; ainsi que l'introduction de doubles liaisons entre C-2 et C-3.
En position terminale linéaire, la fixation d'une partie acide sialique à une chaîne oligosaccharidique implique une liaison α-glucosidique entre le groupe hydroxyle du carbone anomérique C-2 de l'acide sialique et les groupes hydroxyle des carbones C-3, C- .4 ou C-6 de la portion monosaccharide.
Ces liaisons peuvent être entre les résidus galactose, la N-acétylglucosamine, la N-acétylgalactosamine et dans certains gangliosides uniques, le glucose. Ils peuvent se produire par des liaisons N-glycosidiques ou O-glycosidiques.
Caractéristiques
On pense que les acides sialiques aident les organismes parasites à survivre dans l'organisme hôte; des exemples en sont des pathogènes de mammifères qui produisent des enzymes du métabolisme de l'acide sialique (sialidases ou lyases N-acétylneuraminiques).
Il n'y a pas d'espèces de mammifères pour lesquelles la présence d'acides sialiques n'a pas été signalée dans le cadre des glycoprotéines en général, des glycoprotéines sériques, de la muqueuse, dans le cadre des structures de surface cellulaire ou dans le cadre d'hydrates de carbone complexes.
Ils ont été trouvés dans les oligosaccharides acides du lait et du colostrum des humains, des bovins, des moutons, des chiens et des porcs, ainsi que dans l'urine des rats et des humains..
Rôle dans les processus d'adhésion cellulaire
Les glycoconjugués avec des portions d'acide sialique jouent un rôle important dans les processus d'échange d'informations entre les cellules voisines et entre les cellules et leur environnement..
La présence d'acide sialique dans les membranes cellulaires contribue à l'établissement d'une charge négative en surface, ce qui a des conséquences positives dans certains événements de répulsion électrostatique entre les cellules et certaines molécules..
De plus, la charge négative confère aux acides sialiques de la membrane une fonction dans le transport des ions chargés positivement..
Il a été rapporté que la liaison de l'endothélium et de l'épithélium à la membrane basale glomérulaire est facilitée par l'acide sialique, ce qui influence également le contact entre ces cellules..
Rôle dans la durée de vie des composants des cellules sanguines
L'acide sialique a des fonctions importantes dans le cadre de la glycophorine A dans la membrane plasmique des érythrocytes. Certaines études ont montré que la teneur en acide sialique est inversement proportionnelle à l'âge de ces cellules.
Les érythrocytes traités avec des enzymes neuraminidases, responsables de la dégradation de l'acide sialique, diminuent considérablement leur demi-vie dans le sang de 120 jours à quelques heures. Le même cas a été observé avec les plaquettes.
Les thrombocytes perdent leur capacité d'adhésion et d'agrégation en l'absence d'acide sialique dans leurs protéines de surface. Dans les lymphocytes, l'acide sialique joue également un rôle important dans les processus d'adhésion et de reconnaissance cellulaires, ainsi que dans l'interaction avec les récepteurs de surface..
Fonctions du système immunitaire
Le système immunitaire est capable de faire la distinction entre ses propres structures ou celles envahissantes en fonction de la reconnaissance des modèles d'acide sialique présents dans les membranes.
L'acide sialique, ainsi que les enzymes neuraminidase et sialyltransférase, possèdent des propriétés régulatrices importantes. Les parties terminales de l'acide sialique dans les glycoconjugués de la membrane plasmique ont des fonctions de masquage ou de récepteurs membranaires..
De plus, divers auteurs ont évoqué la possibilité que l'acide sialique ait des fonctions antigéniques, mais cela n'est pas encore connu avec certitude. Cependant, les fonctions de masquage des résidus d'acide sialique sont très importantes dans la régulation cellulaire..
Le masquage peut avoir un rôle protecteur direct ou indirect, selon que la partie acide sialique recouvre directement le résidu glucidique antigénique, ou qu'il s'agit d'un acide sialique dans un glycoconjugué adjacent qui masque la partie antigénique..
Certains anticorps possèdent des résidus Neu5Ac qui présentent des propriétés de neutralisation des virus, car ces immunoglobulines sont capables d'empêcher l'adhésion des virus uniquement aux conjugués (glycoconjugués avec des portions d'acide sialique) sur la membrane cellulaire..
Autres fonctions
Dans le tractus intestinal, les acides sialiques jouent un rôle tout aussi important, car ils font partie des mucines, qui ont des propriétés lubrifiantes et protectrices, essentielles pour tout l'organisme..
En outre, les acides sialiques sont également présents dans les membranes des cellules épithéliales bronchiques, gastriques et intestinales, où ils sont impliqués dans le transport, la sécrétion et d'autres processus métaboliques..
Maladies
De nombreuses maladies sont connues pour impliquer des anomalies du métabolisme de l'acide sialique et celles-ci sont connues sous le nom de sialidose. Parmi les plus importantes figurent la sialurie et la maladie de Salla, qui se caractérisent par une excrétion urinaire avec de grandes quantités d'acides sialiques libres..
D'autres maladies d'ordre immunologique sont liées à des altérations des enzymes anaboliques et cataboliques liées au métabolisme de l'acide sialique, qui provoquent une accumulation aberrante de glycoconjugués avec des portions d'acide sialique..
Certaines maladies liées aux facteurs sanguins sont également connues, comme la thrombocytopénie, qui consiste en une diminution du taux de thrombocytes dans le sang, probablement causée par un manque d'acide sialique dans la membrane..
La maladie de von Willebrand correspond à un défaut de la capacité des thrombocytes à adhérer aux glycoconjugués de la membrane sous-endothéliale de la paroi du vaisseau sanguin, causé par des carences ou des carences en glycosylation ou sialylation.
La thrombasthénie de Glanzmann est un autre trouble congénital de l'agrégation des thrombocytes dont la racine est la présence de glycoprotéines défectueuses dans la membrane des thrombocytes. Il a été démontré que les défauts de ces glycoprotéines sont associés à une teneur réduite en Neu5Ac.
Les références
- Clayden, J., Greeves, N., Warren, S., et Wothers, P. (2001). Chimie organique (1ère éd.). New York: Presse universitaire d'Oxford.
- Demchenko, A. V. (2008). Manuel de glycosylation chimique: progrès de la stéréosélectivité et de la pertinence thérapeutique. Wiley-VCH.
- Rosenberg, A. (1995). Biologie des acides sialiques. New York: Springer Science + Business Media, LLC.
- Schauer, R. (1982). Acides sialiques: chimie, métabolisme et fonction. Springer-Verlag Wien New York.
- Traving, C. et Schauer, R. (1998). Structure, fonction et métabolisme des acides sialiques. Sciences de la vie cellulaires et moléculaires du CMLS, 54, 1330-1349.



Personne n'a encore commenté ce post.