
Structure de l'acide sulfanilique, propriétés, synthèse, utilisations

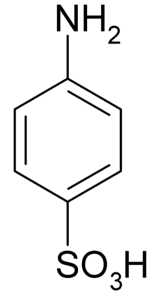
le acide sulfanilique est un composé cristallin dont la molécule est formée par un cycle benzénique auquel un groupe basique (-NHdeux) et un groupe acide (-SO3H). Sa formule chimique est NHdeuxC6H4SW3H.
Il est également connu sous le nom d'acide 4-aminobenzènesulfonique. Il est préparé par sulfonation de l'aniline en position para. Ses cristaux sont blancs ou blanc grisâtre. Son comportement ressemble plus à celui d'un sel qu'à celui d'un composé organique à groupements NHdeux ours3H. Par conséquent, il est insoluble dans la plupart des solvants organiques.
L'une de ses principales utilisations est la synthèse de colorants, car il forme facilement un composé diazo qui est une matière première pour cette application..
L'acide sulfanilique et ses dérivés ont été utilisés comme agents antibactériens. Il est utilisé dans la synthèse de composés mucolytiques, car ils ont la capacité de diminuer la viscosité du mucus ou des fluides biologiques très visqueux..
Il est également utilisé dans l'industrie papetière et dans les formules de gravure ou de lithographie. Il fait partie des résines qui sont utilisées dans les mélanges de béton ou de mortier pour leur permettre de conserver leur fluidité pendant longtemps, sans influencer le temps de prise final..
C'est un métabolite xénobiotique, cela signifie qu'il n'est pas produit naturellement par les êtres vivants. Il est irritant pour la peau, les yeux et les muqueuses. De plus, il peut polluer l'environnement.
Index des articles
- 1 Structure
- 2 Nomenclature
- 3 propriétés
- 3.1 État physique
- 3.2 Poids moléculaire
- 3.3 Point de fusion
- 3.4 Densité
- 3.5 Solubilité
- 3.6 Propriétés chimiques
- 3.7 Autres propriétés
- 4 Synthèse
- 5 utilisations
- 5.1 Dans l'industrie de la teinture
- 5.2 En chimie analytique
- 5.3 En médecine comme agent antibactérien
- 5.4 En médecine comme agent mucolytique
- 5.5 Dans les laboratoires de bioanalyse
- 5.6 Dans l'industrie papetière
- 5.7 Dans les estampes, gravures ou lithographies
- 5.8 Dans les matériaux de construction
- 6 Références
Structure
L'acide sulfanilique a des cristaux blancs formés par des feuilles orthorhombiques ou monocliniques. Son monohydrate cristallise dans l'eau sous forme de feuilles orthorhombiques. Si la cristallisation se déroule très lentement, le dihydrate cristallise. Le monohydrate devient anhydre lorsqu'il est proche de 100 ºC.
Nomenclature
- Acide sulfanilique.
- Acide P-Aminobenzènesulfonique.
- Acide 4-aminobenzènesulfonique.
Propriétés
État physique
Solide cristallin blanc ou blanc cassé.
Poids moléculaire
173,19 g / mol.
Point de fusion
Il se décompose à environ 288 ° C sans fondre. Il est également signalé à> 320 ºC.
Densité
1,49 g / cm3
Solubilité
Presque insoluble dans l'eau: 10,68 g / L à 20 ºC.
Insoluble dans l'éthanol, le benzène et l'éther. Légèrement soluble dans le méthanol chaud.
Soluble dans les solutions aqueuses de bases. Insoluble dans les solutions aqueuses d'acides minéraux. Soluble dans l'acide chlorhydrique concentré.
Propriétés chimiques
Ses propriétés diffèrent de celles d'autres composés aminés ou sulfonés, étant similaires à celles d'un sel. C'est parce que sa structure contient en fait les groupes -NH3+ Et donc3-, ce qui lui confère des caractéristiques zwitterioniques.
Il contient un groupe acide et un groupe basique aux pôles opposés de la même molécule. Mais l'ion hydrogène est lié à l'azote au lieu de l'oxygène parce que le groupe -NHdeux est une base plus solide que le groupe -SO3-.
Parce que c'est un zwitterion, il a un point de fusion élevé et une insolubilité dans les solvants organiques..
L'acide sulfanilique est soluble en solution alcaline car l'ion hydroxyde OH-, étant fortement basique, il démarre un ion hydrogène (H+) du groupe basique faible -NHdeux, formant l'ion p-aminobenzènesulfonate, qui est soluble dans l'eau.
En solution acide, la structure de l'acide sulfanilique ne change pas, il reste donc insoluble.
Autres propriétés
Lorsqu'il est chauffé jusqu'à décomposition, il émet des fumées toxiques d'oxydes d'azote et de soufre.
L'exposition à l'acide sulfanilique peut entraîner des symptômes tels qu'une irritation de la peau, des yeux et des muqueuses. C'est un composé corrosif.
La synthèse
Il est préparé en faisant réagir l'aniline avec de l'acide sulfurique (HdeuxSW4) à des températures élevées. Initialement, le sel de sulfate d'anilinium acide est formé, qui, lorsqu'il est chauffé à 180-200 ºC, est réorganisé pour former le cycle substitué en position para, car c'est le produit le plus stable..
Pour le préparer avec un haut degré de pureté, la sulfonation d'un mélange d'aniline et de sulfolane avec HdeuxSW4 à 180-190 ºC.
Applications
Dans l'industrie de la teinture
L'acide sulfanilique est utilisé dans la synthèse ou la préparation de divers colorants, tels que le méthylorange et la tartrazine. Pour cela, il est diazoté, générant de l'acide sulfanilique diazotisé..
Il est important de noter que la tartrazine a été utilisée comme colorant dans les aliments. Mais une fois ingéré, il génère certains métabolites dans le corps humain, dont l'acide sulfanilique, qui sont probablement responsables de la formation d'espèces réactives de l'oxygène. Ceux-ci peuvent affecter les tissus des reins (reins) ou du foie (foie)..

En chimie analytique
Il est utilisé comme réactif dans la détermination de divers composés chimiques, y compris les nitrites..
En médecine comme agent antibactérien
Le sulfanilamide, dérivé de l'acide sulfanilique, a une application dans l'industrie pharmaceutique car il a une activité antibactérienne.
Dans le corps humain, les bactéries le confondent avec l'acide p-aminobenzoïque, qui est un métabolite essentiel. Cette substitution signifie que les bactéries ne se reproduisent pas et meurent.
Un autre dérivé de l'acide sulfanilique, obtenu par condensation avec d'autres composés, possède également des propriétés antibactériennes, qui sont basées sur sa capacité à déplacer l'acide folique (un membre du complexe de la vitamine B)..
Ce composé peut être pris par voie orale, injecté par voie intraveineuse ou appliqué à l'extérieur dans une pommade..
En médecine comme agent mucolytique
Un dérivé d'acide sulfanilique qui a une activité mucolytique a été utilisé. C'est qu'il présente une activité liquéfactive du mucus, pour dissoudre le mucus lui-même ou des fluides biologiques très visqueux.
Le composé peut être utilisé pour produire une liquéfaction du mucus produit par un tissu en raison de conditions pathologiques. Par exemple, la congestion du système respiratoire ou celle des voies vaginales, entre autres.
En ce qui concerne la liquéfaction du mucus dans les voies respiratoires, le produit est administré par inhalation, gouttes dans le nez, brouillard, aérosols ou nébuliseurs. C'est un traitement applicable aux humains ou aux mammifères. C'est un composé plus puissant que ceux à base de cystéine.

Il est également utilisé en laboratoire lorsque l'on souhaite réduire la viscosité des fluides biologiques pour faciliter les déterminations analytiques..
Dans les laboratoires de bioanalyse
L'acide sulfanilique diazotisé (un dérivé préparé en faisant réagir l'acide sulfanilique avec du nitrite de sodium) est utilisé dans le dosage de la bilirubine.
La bilirubine est un pigment jaune présent dans la bile. L'excès de bilirubine dans le sang est une conséquence de maladies hépatiques, de troubles hématologiques (ou sanguins) ou de troubles des voies biliaires.
Pour mesurer la quantité de bilirubine dans le sang, le diazo dérivé de l'acide sulfanilique est mis à réagir avec la bilirubine pour former le complexe azobilirubine dont l'intensité est mesurée avec un colorimètre ou un spectrophotomètre. De cette manière, la teneur en bilirubine dans le sérum sanguin est déterminée..
Dans l'industrie papetière
L'acide sulfanilique permet de synthétiser un cirage à papier, c'est-à-dire un composé qui lui confère une brillance optique ou un aspect blanc, puisqu'il neutralise la couleur jaune du papier naturel ou non traité..

Il présente l'avantage par rapport aux autres composés en ce qu'il peut être utilisé à des concentrations relativement élevées pour traiter la pâte à papier dans des conditions de pH bas, sans augmenter le jaunissement du papier..
Le résultat est évident lorsque le papier est observé avec une lumière UV (ultraviolette), sous laquelle il fluoresce beaucoup plus que lorsque d'autres composés sont utilisés, et avec la lumière visible, on observe que le degré de jaunissement est très faible.
Il est très soluble dans l'eau, ce qui lui permet d'être utilisé dans des solutions plus concentrées. Peut être utilisé sur tout type de papier, y compris le papier produit à partir de pâte de bois broyée, de pâte au sulfite ou tout autre procédé.
Dans les estampes, gravures ou lithographies
L'acide sulfanilique agit comme acidifiant dans les solutions concentrées pour la lithographie, sans présenter les problèmes d'autres acides comme le phosphorique, étant moins toxique et moins polluant que ce dernier..
Dans les matériaux de construction
Des solutions aqueuses de résine mélamine-formaldéhyde modifiées à l'acide sulfanilique ont été testées dans du béton (béton), du mortier ou de la pâte de ciment. Le but était de réduire la teneur en eau et d'éviter une diminution de la fluidité du mélange au fil du temps, sans réduire le temps de prise..
Le béton ou mortier préparé avec ces solutions est très efficace en été, lorsque la diminution de la fluidité avec le temps est un problème..
Avec ces solutions, si le mortier ou le béton est préparé et pour quelque raison que ce soit doit être laissé au repos, la composition de ciment peut être facilement coulée dans des moules ou similaires, car elle n'a pas perdu de fluidité avec le temps..

Les références
- Windholz, M. et coll. (éditeurs) (1983). L'indice Merck. Une encyclopédie des produits chimiques, des médicaments et des produits biologiques. Dixième édition. Merck & CO., Inc.
- Kirk-Othmer (1994). Encyclopédie de la technologie chimique. Volume 2. Quatrième édition. John Wiley et fils.
- Bibliothèque nationale de médecine. (2019). Acide sulfanilique. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Urist, H. et Martin, G.J. (1950). Dérivés d'acide sulfanilique. Brevet américain n ° 2,504,471. Cédants à la National Drug Company. 18 avril 1950.
- Villaume, Frederick G. (1964). Composition azurante pour papier dérivée des acides méthanilique et sulfanilique. Brevet américain n ° 3 132 106. 5 mai 1964.
- Martin, Tellis A. et Comer, William T. (1979). Dérivé d'acide benzoïque et processus mucolytique d'acide benzènesulfonique. Brevet américain n ° 4 132 802. 2 janvier 1979.
- Druker, L.J. et Kincaid, R.B. (1979). Concentré de fontaine lithographique. Brevet américain n ° 4,150,996. 24 avril 1979.
- Shull, Bruce C. (1983). Dosage de la bilirubine. Brevet américain n ° 4 404 286. 13 septembre 1983.
- Uchida, J. et coll. (2001). Procédé de préparation d'une solution aqueuse de résine mélamine-formaldéhyde modifiée à l'acide sulfanilique et d'une composition de ciment. Brevet américain n ° 6 214 965 B1. 10 avril 2001.
- Corradini, M.G. (2019). Volume 1. Dans Encyclopedia of Food Chemistry. Récupéré de sciencedirect.com.



Personne n'a encore commenté ce post.