
Propriétés et utilisations de l'acide iodé (HIO2)

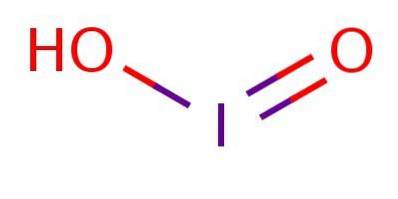
le acide iodé C'est un composé chimique de formule HIO2. Cet acide, ainsi que ses sels (appelés iodites), sont des composés extrêmement instables qui ont été observés mais jamais isolés.
C'est un acide faible, ce qui signifie qu'il ne se dissocie pas complètement. Dans l'anion, l'iode est à l'état d'oxydation III et a une structure analogue à l'acide chloreux ou à l'acide bromeux, comme illustré sur la figure 1.
Bien que le composé soit instable, l'acide iodé et ses sels d'iodite ont été détectés comme intermédiaires dans la conversion entre les iodures (I-) et les iodates (IO3-).
Son instabilité est due à une réaction de dismutation (ou disproportion) pour former de l'acide hypoiodoïde et de l'acide iodique, qui est analogue aux acides chloreux et bromeux de la manière suivante:
2HIO2 -> HIO + HIO3
À Naples en 1823, le scientifique Luigi Sementini a écrit une lettre à E. Daniell, secrétaire de l'institution royale de Londres, où il a expliqué une méthode pour obtenir de l'acide iodé.
Dans la lettre, il a dit que considérant que la formation d'acide nitreux était de combiner l'acide nitrique avec ce qu'il appelait le gaz nitreux (peut-être NdeuxO), l'acide iodique pourrait être formé de la même manière en faisant réagir l'acide iodique avec l'oxyde d'iode, un composé qu'il avait découvert.
Ce faisant, il a obtenu un liquide jaunâtre-ambre qui a perdu sa couleur au contact de l'atmosphère (Sir David Brewster, 1902).
Plus tard, le scientifique M. Wöhler a découvert que l'acide de Sementini est un mélange de chlorure d'iode et d'iode moléculaire, puisque l'oxyde d'iode utilisé dans la réaction a été préparé avec du chlorate de potassium (Brande, 1828).
Index des articles
- 1 Propriétés physiques et chimiques
- 2 utilisations
- 2.1 Acylation nucléophile
- 2.2 Réactions de démutation
- 2.3 Réactions de Bray-Liebhafsky
- 3 Références
Proprietes physiques et chimiques
Comme mentionné ci-dessus, l'acide iodé est un composé instable qui n'a pas été isolé, de sorte que ses propriétés physiques et chimiques sont théoriquement obtenues par des calculs et des simulations informatiques (Royal Society of Chemistry, 2015).
L'acide iodé a un poids moléculaire de 175,91 g / mol, une densité de 4,62 g / ml à l'état solide, un point de fusion de 110 degrés centigrades (acide iodé, 2013-2016).
Il a également une solubilité dans l'eau de 269 g / 100 ml à 20 degrés Celsius (étant un acide faible), un pKa de 0,75 et une susceptibilité magnétique de -48,0 · 10−6 cm3 / mol (National Center for Biotechnology Informations, sf).
Puisque l'acide iodé est un composé instable qui n'a pas été isolé, il n'y a aucun risque de le manipuler. Il a été constaté par des calculs théoriques que l'acide iodé n'est pas inflammable..
Applications
Acylation nucléophile
L'acide iodé est utilisé comme nucléophile dans les réactions d'acylation nucléophile. L'exemple est donné avec l'acylation de trifluoroacétyles tels que le bromure de 2,2,2-trifluoroacétyle, le chlorure de 2,2,2-trifluoroacétyle, le fluorure de 2,2,2-trifluoroacétyle et l'iodure de 2,2,2-trifluoroacétyle pour former le iodosyl 2,2,2 trifluoroacétate comme illustré dans les figures 2.1, 2.2, 2.3 et 2.4 respectivement.

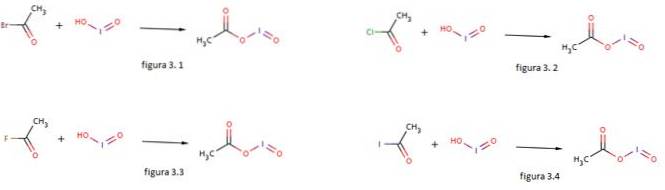
L'acide iodé est également utilisé comme nucléophile pour la formation d'acétate d'iodosyle en le faisant réagir avec du bromure d'acétyle, du chlorure d'acétyle, du fluorure d'acétyle et de l'iodure d'acétyle, comme le montrent les figures 3.1, 3.2, 3.3 et 3.4 respectivement (GNU Free Documentation, sf).
Réactions de démutation
Les réactions de démutation ou de disproportionation sont un type de réaction de réduction des oxydes, où la substance qui est oxydée est la même que celle qui est réduite.
Dans le cas des halogènes, comme ils ont des états d'oxydation de -1, 1, 3, 5 et 7, différents produits de réactions de dismutation peuvent être obtenus en fonction des conditions utilisées..
Dans le cas de l'acide iodique, l'exemple de sa réaction pour former de l'acide hypoiode et de l'acide iodique de la forme.
2HIO2 -> HIO + HIO3
Des études récentes ont analysé la réaction de dismutation de l'acide iodé en mesurant les concentrations de protons (H+), iodate (IO3-) et le cation hypoiodite acide (HdeuxIO+) afin de mieux comprendre le mécanisme de la dismutation iodée acide (Smiljana Marković, 2015).
Une solution a été préparée contenant les espèces intermédiaires I3+. Un mélange d'espèces iode (I) et iode (III) a été préparé en dissolvant de l'iode (Ideux) et l'iodate de potassium (KIO3), dans le rapport 1: 5, en acide sulfurique concentré (96%). Dans cette solution se déroule une réaction complexe, qui peut être décrite par la réaction:
jedeux + 3IO3- + 8H+ -> 5IO+ + HdeuxOU ALORS
Espèce I3+ ils ne sont stables qu'en présence d'un excès d'iodate ajouté. L'iode empêche la formation de je3+. L'ion IO+ Obtenu sous forme de sulfate d'iode (IO) deuxSW4), se décompose rapidement en solution aqueuse acide et forme I3+, représenté comme acide HIOdeux ou l'espèce ionique IO3-. Par la suite, une analyse spectroscopique a été réalisée pour déterminer la valeur des concentrations des ions d'intérêt..
Cela a présenté une procédure pour l'évaluation des concentrations de pseudo-équilibre en ions hydrogène, iodate et H.deuxJ'AI ENTENDU+, Espèces cinétiques et catalytiques importantes dans le processus de disproportionation de l'acide iodé, HIOdeux.
Réactions de Bray-Liebhafsky
Une horloge chimique ou une réaction d'oscillation est un mélange complexe de composés chimiques en réaction, dans lequel la concentration d'un ou plusieurs composants change périodiquement ou lorsque des changements soudains de propriétés se produisent après un temps d'induction prévisible.
Il s'agit d'une classe de réactions qui servent d'exemple de thermodynamique hors équilibre, aboutissant à la mise en place d'un oscillateur non linéaire. Ils sont théoriquement importants car ils montrent que les réactions chimiques ne doivent pas être dominées par un comportement thermodynamique à l'équilibre..
La réaction de Bray-Liebhafsky est une horloge chimique décrite pour la première fois par William C. Bray en 1921 et est la première réaction d'oscillation dans une solution homogène agitée..
L'acide iodé est utilisé expérimentalement pour étudier ce type de réaction lorsqu'il est oxydé avec du peroxyde d'hydrogène, trouvant un meilleur accord entre le modèle théorique et les observations expérimentales (Ljiljana Kolar-Anić, 1992).
Les références
- Brande, W. T. (1828). Un manuel de chimie, sur la base de celui du professeur Brande. Boston: Université de Harvard.
- Documentation libre GNU. (s.f.). acide iodé. Récupéré de chemsink.com: chemsink.com
- acide iodé. (2013-2016). Récupéré de molbase.com: molbase.com
- Ljiljana Kolar-Anić, G. S. (1992). Mécanisme de la réaction de Bray-Liebhafsky: effet de l'oxydation de l'acide iodé par le peroxyde d'hydrogène. Chem. Soc., Faraday Trans 1992, 88, 2343-2349. http://pubs.rsc.org/en/content/articlelanding/1992/ft/ft9928802343#!divAbstract
- Centre national d'information sur la biotechnologie. (n.d.). Base de données des composés PubChem; CID = 166623. Récupéré de pubchem.com:pubchem.ncbi.nlm.nih.gov.
- Société royale de chimie. (2015). Acide iodé ChemSpider ID145806. Récupéré de ChemSpider: chemspider.com
- Sir David Brewster, R. T. (1902). Le magazine philosophique de Londres et d'Édimbourg et le Journal of Science. londres: université de londres.
- Smiljana Marković, R. K. (2015). Réaction de disproportionation d'acide iodé, HOIO. Détermination des concentrations des espèces ioniques pertinentes H +, H2OI + et IO3 -.


Personne n'a encore commenté ce post.