
Propriétés, risques et utilisations du chlorure de lithium (LiCl)
le Chlorure de lithium C'est un composé chimique de formule LiCl qui peut être fabriqué en enflammant du lithium et du chlore, bien que cela soit difficile car la réaction est violente. De cette manière, la forme anhydre (sans eau) est produite. Le chlorure de lithium peut également être extrait d'autres chlorures de métaux alcalins avec de l'alcool amylique..
Jusque dans les années 1990, le marché des métaux et du lithium était dominé par la production américaine à partir de gisements minéraux. Cependant, au début du XXIe siècle, la majeure partie de la production provenait de sources non américaines, l'Australie, le Chili et le Portugal étant les principaux fournisseurs au monde..
Par curiosité, il convient de noter que, bien que la Bolivie possède la moitié des gisements de lithium du monde, ce n'est pas un grand producteur.
La forme commerciale la plus importante est le carbonate de lithium, LideuxCO3, produit à partir de minéraux ou de saumures par plusieurs procédés différents.
L'ajout d'acide chlorhydrique (HCl) produit du chlorure de lithium. Avec cette méthode, le composé hydraté (eau liée à la molécule) est produit. La forme hydratée peut être séchée jusqu'à la forme anhydre en la chauffant avec du chlorure d'hydrogène gazeux..
Propriétés physiques et chimiques du chlorure de lithium
Le chlorure de lithium est un solide blanc sans arôme particulier et au goût salé (National Center for Biotechnology Information, 2005). Son apparence est illustrée à la figure 2.

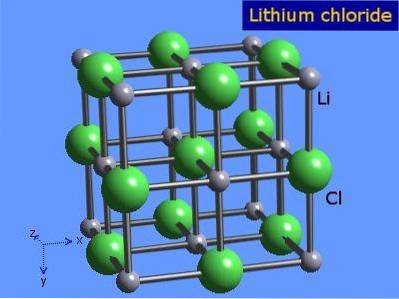
Le chlorure de lithium sont des cristaux hautement hygroscopiques avec une géométrie octaédrique similaire à celle du chlorure de sodium. Sa structure cristalline est présentée sur la figure 3 (Winter, S.F.).
Son poids moléculaire est de 42,39 g / mol, sa densité de 2,068 g / ml et ses points de fusion et d'ébullition sont respectivement de 605 ºC et 1360 ºC..
Le composé est très soluble dans l'eau, l'alcool, l'éther, la pyridine et le nitrobenzène (Royal Society of Chemistry, 2015).
Le chlorure de lithium a un faible pouvoir oxydant ou réducteur. Cependant, des réactions redox peuvent encore se produire. Les solutions de chlorure de lithium ne sont généralement ni fortement acides ni fortement basiques..
Puisqu'il est extrêmement hygroscopique, le chlorure de lithium peut également absorber jusqu'à quatre équivalents d'ammoniac par mole. Les solutions aqueuses de chlorure de lithium peuvent corroder les métaux (LITHIUM CHLORIDE, S.F.).
Réactivité et dangers
Le chlorure de lithium est un composé stable incompatible avec les agents oxydants forts, les acides forts, le trichlorure de brome, le trifluorure de brome.
Il n'est pas toxique en cas d'ingestion, mais en raison de sa nature corrosive, il peut être irritant au contact de la peau et des yeux, il peut également irriter les voies nasales (National Institute for Occupational Safety and Health, 2015).
En cas de contact avec les yeux, vérifiez si vous portez des lentilles de contact et retirez-les immédiatement..
Les yeux doivent être rincés à l'eau courante pendant au moins 15 minutes, en gardant les paupières ouvertes. De l'eau froide peut être utilisée. La pommade oculaire ne doit pas être utilisée.
Si le produit chimique entre en contact avec les vêtements, retirez-le le plus rapidement possible, en protégeant vos propres mains et votre corps.
Placez la victime sous une douche de sécurité. Si le produit chimique s'accumule sur la peau exposée de la victime, comme les mains, la peau contaminée est lavée doucement et soigneusement à l'eau courante et au savon non abrasif..
De l'eau froide peut être utilisée. Si l'irritation persiste, consulter un médecin. Lavez les vêtements contaminés avant de les réutiliser.
En cas d'inhalation, la victime doit être autorisée à se reposer dans un endroit bien ventilé. Si l'inhalation est sévère, la victime doit être évacuée vers une zone sûre dès que possible..
Desserrez les vêtements serrés comme un col de chemise, une ceinture ou une cravate. Si la victime a du mal à respirer, de l'oxygène doit être administré.
Si la victime ne respire pas, une réanimation bouche-à-bouche est effectuée. Gardez toujours à l'esprit qu'il peut être dangereux pour la personne aidant de pratiquer la réanimation bouche-à-bouche lorsque le produit inhalé est toxique, infectieux ou corrosif..
Dans tous les cas, une attention médicale immédiate doit être recherchée (Fiche de données de sécurité Chlorure de lithium, 2013).
Applications
Le chlorure de lithium est le composé utilisé pour produire du lithium métal par électrolyse. Le lithium métal est produit par électrolyse d'un mélange fondu de chlorures de lithium et de potassium.
Le point de fusion inférieur du mélange (400-420 ° C ou 750-790 ° F) par rapport à celui du chlorure de lithium pur (610 ° C ou 1130 ° F) permet le fonctionnement à une température plus basse de l'électrolyse.
Étant donné que la tension à laquelle se produit la décomposition du chlorure de lithium est inférieure à celle du chlorure de potassium, le lithium se dépose à un niveau de pureté supérieur à 97% (Dye, 2017).
Le chlorure de lithium liquide sert d'agent déshydratant qui peut réduire les niveaux d'humidité dans l'air ambiant jusqu'à 15 pour cent.
Les dessicants liquides qui combinent le chlorure de lithium et le chlorure de calcium créent une substance moins chère que le chlorure de lithium, mais plus stable que le chlorure de calcium..
Le chlorure de lithium refroidit l'air rapidement parce que le produit chimique contient une énorme quantité d'eau pour son poids en tant que solide. La substance sèche également de grandes quantités de gaz industriels.
Le chlorure de lithium est un colorant rouge dans les expositions pyrotechniques telles que les feux d'artifice. Le chlorure de lithium, ou tout sel à base de lithium soluble dans l'eau, brûle en rouge lorsqu'il est allumé.
Des effets pyrotechniques spéciaux peuvent être enflammés en mélangeant des sels ioniques avec des liquides inflammables tels que l'alcool méthylique..
Dans les années 1940, le chlorure de lithium a servi de substitut au sel de table, mais certains patients sont décédés de niveaux toxiques de lithium..
Le composé a des applications pharmacologiques en tant qu'antimaniacs, qui sont des agents utilisés pour traiter les troubles bipolaires ou la manie associés à d'autres troubles affectifs..
Le corps humain contient normalement environ 7 milligrammes de lithium à un moment donné..
Le lithium est naturellement présent dans les plantes car les organismes utilisent la substance pour stimuler la croissance.
Les références
- Dye, J. L. (23 janvier 2017). Lithium (Li). Récupéré de britannica: britannica.com.
- EMBL-EBI. (23 novembre 2009). chlorure de lithium. Récupéré de ChEBI: ebi.ac.uk.
- CHLORURE DE LITHIUM. (S.F.). Récupéré de CAMEO: cameochemicals.noaa.gov.
- Fiche signalétique Chlorure de lithium. (2013, 21 mai). Récupéré de sciencelab.com.
- Centre national d'information sur la biotechnologie… (26 mars 2005). Base de données des composés PubChem; CID = 433294. Récupéré de PubChem.
- Institut national pour la sécurité et la santé au travail. (2015, 22 juillet). CHLORURE DE LITHIUM. Récupéré de cdc.gov.
- Hiver, M. (S.F.). Lithium: chlorure de lithium. Récupéré de Webelements.



Personne n'a encore commenté ce post.