
Propriétés, structure, utilisations, risques du chlorure de manganèse

le chlorure de manganèse est un sel inorganique dont la formule chimique est MnCldeux. Il est composé d'ions Mndeux+ et Cl- dans un rapport 1: 2; pour chaque cation Mndeux+ il y a deux fois plus d'anions Cl-.
Ce sel peut former divers hydrates: MnCldeux2HdeuxO, (dihydraté), MnCldeux4HdeuxO (tétrahydrate) et MnCldeux6HdeuxO (hexahydraté) La forme la plus courante de sel est le tétrahydrate.

Les propriétés physiques du chlorure de manganèse telles que la densité, le point de fusion et la solubilité dans l'eau, sont influencées par son degré d'hydratation. Par exemple, le point de fusion de la forme anhydre est beaucoup plus élevé que celui de la forme tétrahydrate..
La couleur du chlorure de manganèse est rose pâle (image du haut). La pâleur est caractéristique des sels de métaux de transition. Le chlorure de manganèse est un acide de Lewis faible.
Le minéral connu sous le nom d'escacquita est la forme naturellement anhydre du chlorure de manganèse (II); comme la kempita.
Le chlorure de manganèse (II) est utilisé comme agent d'alliage; catalyseur dans les réactions de chloration, etc..
Index des articles
- 1 Propriétés physiques
- 1.1 Apparence physique
- 1.2 Masses molaires
- 1.3 Points de fusion
- 1.4 Point d'ébullition
- 1.5 Densités
- 1.6 Solubilité dans l'eau
- 1.7 Solubilité dans les solvants organiques
- 1.8 Décomposition
- 1,9 pH
- 1.10 Stabilité
- 2 Structure du chlorure de manganèse
- 2.1 Dihydrate
- 2.2 Anhydre
- 3 Nomenclature
- 4 utilisations
- 4.1 Laboratoire
- 4.2 Industrie
- 4.3 Engrais et aliments pour animaux
- 5 risques
- 6 Références
Propriétés physiques
Aspect physique
- Forme anhydre: cristaux cubiques roses.
- Forme tétrahydrate: cristaux monocliniques rougeâtres légèrement déliquescents.
Masses molaires
- Anhydre: 125,838 g / mol.
- Dihydrate: 161,874 g / mol.
- Tétrahydrate: 197,91 g / mol.
Point de fusion
- Anhydre: 654 ºC.
- Dihydrate: 135 ºC.
- Tétrahydrate: 58 ºC.
Point d'ébullition
Forme anhydre: 1190 ºC.
Les densités
- Anhydre: 2977 g / cm3.
- Dihydrate: 2,27 g / cm3.
- Tétrahydrate: 2,01 g / cm3.
Solubilité dans l'eau
Forme anhydre: 63,4 g / 100 ml à 0 ° C; 73,9 g / 100 ml à 20 ° C; 88,5 g / 100 ml à 40 ° C; et 123,8 g / 100 ml à 100 ° C.
Solubilité dans les solvants organiques
Soluble dans la pyridine et l'éthanol, insoluble dans l'éther.
Décomposition
A moins que des précautions appropriées ne soient prises, la déshydratation des formes hydratées en forme anhydre peut conduire à une déshydratation hydrolytique, avec production de chlorure d'hydrogène et d'oxychlorure de manganèse..
pH
Une solution 0,2 M de chlorure de manganèse tétrahydraté en solution aqueuse a un pH de 5,5.
Stabilité
Il est stable, mais sensible à l'humidité et incompatible avec les acides forts, les métaux réactifs et le peroxyde d'hydrogène.
Structure du chlorure de manganèse

En commençant par le sel tétrahydraté, avec des cristaux roses frappants, il doit être constitué de complexes de coordination (image du haut). En eux, le centre métallique de Mndeux+ est entouré d'un octaèdre défini par quatre molécules de HdeuxO et deux anions Cl-.
Notez que les ligands Cl- sont en position cis; tous sont équivalents dans la base rectangulaire de l'octaèdre, et peu importe si le Cl est "déplacé"- à l'une des trois autres positions. Un autre isomère possible pour cette molécule coordonnée est dans lequel les deux Cl- sont en position trans; c'est-à-dire dans différents extrêmes (l'un au-dessus et l'autre en dessous).
Les quatre molécules d'eau avec leurs liaisons hydrogène permettent à deux octaèdres ou plus d'être reliés par des forces dipôle-dipôle. Ces ponts sont hautement directionnels, et en ajoutant les interactions électrostatiques entre le Mndeux+ et Cl-, établir une structure ordonnée caractéristique d'un cristal.
La couleur rose du MnCldeux4HdeuxOu est-ce dû aux transitions électroniques du Mndeux+ et sa configuration d5. De même, les perturbations causées par la proximité des molécules d'eau et des chlorures modifient la quantité d'énergie nécessaire pour être absorbée par ces électrons d5 pour voyager à des niveaux d'énergie plus élevés.
Dihydrate
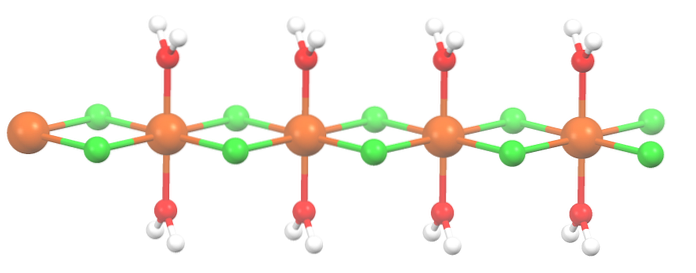
Le sel a été déshydraté et sa formule est maintenant MnCldeux2HdeuxO. Qu'en est-il de l'octaèdre ci-dessus? Rien, sauf que les deux molécules de HdeuxOu ceux qui ont abandonné sont remplacés par deux Cl-.
Au début, vous pouvez donner la fausse impression qu'il y a quatre Cl- pour chaque Mndeux+; cependant, la moitié de l'octaèdre (axialement) est en fait l'unité répétitive du cristal.
Ainsi, il est vrai qu'il existe un Mndeux+ coordonné à deux Cl- et deux molécules d'eau en position trans. Mais pour que cette unité interagisse avec une autre, elle a besoin de deux ponts Cl, ce qui permet à son tour de compléter l'octaèdre de coordination pour le manganèse..
En plus des ponts Cl, les molécules d'eau collaborent également avec leurs liaisons hydrogène afin que cette chaîne MnCldeux2HdeuxOu ne désarme pas.
Anhydre
Enfin, le chlorure de magnésium a fini de perdre toute l'eau contenue dans ses cristaux; nous avons maintenant le sel anhydre, MnCldeux. Sans les molécules d'eau, les cristaux perdent sensiblement l'intensité de leur coloration rose. L'octaèdre, quant aux hydrates, reste inchangé par la nature même du manganèse.
Sans molécules d'eau, Mndeux+ se termine entouré d'un octaèdre composé uniquement de Cl-. Cette liaison de coordination a un caractère à la fois covalent et ionique; pour cette raison, il se réfère généralement à la structure de MnCldeux comme un cristal polymère. Il y a des couches alternées de Mn et Cl.
Nomenclature
Le manganèse a de nombreux états d'oxydation possibles. Pour cette raison, la nomenclature traditionnelle pour MnCldeux ce n'est pas clarifié.
En revanche, le chlorure de manganèse correspond à sa dénomination plus connue, à laquelle il faudrait ajouter le «(II)» pour le mettre en accord avec la nomenclature de la souche: le chlorure de manganèse (II). Et de même, il y a la nomenclature systématique: dichlorure de manganèse.
Applications
Laboratoire
Le chlorure de manganèse sert de catalyseur pour la chloration des composés organiques.
Industrie
Le chlorure de manganèse est utilisé comme matière première pour la fabrication d’antiknockers pour l’essence; matériel de soudage pour métaux non ferreux; intermédiaire dans la fabrication de pigments; et séchoir à huile de lin.
Il est utilisé dans l'industrie textile pour l'impression et la teinture; dans la production de divers sels de manganèse, y compris le méthylcyclopentadiénylmanganèse tricarbonyle utilisé comme colorant de brique; et dans la production de cellules électriques sèches.
Le chlorure de manganèse est utilisé comme agent d'alliage et est ajouté au magnésium fondu pour produire des alliages de manganèse-magnésium; comme intermédiaire dans la préparation d'agents de séchage pour peinture et vernis; et en tant que composant de désinfectants.
Il est également utilisé dans la purification du magnésium.
Engrais et alimentation animale
Le chlorure de manganèse est utilisé comme source de manganèse, un élément qui, bien qu'il ne soit pas un élément nutritionnel primaire pour les plantes comme l'azote, le phosphore et le potassium, est utilisé dans de nombreuses réactions biochimiques typiques de ces êtres vivants..
De même, il est ajouté à l'alimentation des animaux reproducteurs pour fournir du manganèse, oligo-élément essentiel à la croissance des animaux..
Le chlorure de manganèse est un composant alimentaire qui fournit du manganèse, un élément impliqué dans de nombreux processus nécessaires à la vie, notamment: la synthèse d'acides gras et d'hormones sexuelles; assimilation de la vitamine E; production de cartilage; etc.
Des risques
Il peut provoquer des rougeurs, des irritations et des dermatites au contact de la peau. Le chlorure de manganèse provoque des yeux rouges, douloureux et larmoyants.
Lorsqu'il est inhalé, le sel provoque une toux, un mal de gorge et un essoufflement. D'autre part, l'ingestion peut provoquer des vomissements, des nausées et de la diarrhée..
Une inhalation excessive chronique de ce sel peut entraîner une inflammation pulmonaire et une maladie des voies respiratoires réactives..
Son ingestion excessive peut provoquer des troubles mentaux, une déshydratation, une hypotension, une insuffisance hépatique et rénale, une défaillance du système multiorganique et la mort..
La neurotoxicité est la manifestation initiale de l'action indésirable du manganèse et peut présenter des maux de tête, des étourdissements, des pertes de mémoire, une hyperréflexie et des tremblements légers..
Une toxicité sévère se manifeste par des symptômes et des signes similaires à ceux observés dans la maladie de Parkinson.
Les références
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2019). Chlorure de manganèse (II). Récupéré de: en.wikipedia.org
- Nanomatériaux Sky Spring. (2016). Poudre de chlorure de manganèse. Récupéré de: ssnano.com
- Livre chimique. (2017). Chlorure de manganèse. Récupéré de: Chemicalbook.com
- Réseau de données toxicologiques. (s.f.). Chlorure de manganèse. Toxnet. Récupéré de: toxnet.nlm.nih.gov
- Gérard Cahiez. (2001). Chlorure de manganèse (II). doi.org/10.1002/047084289X.rm020
- Centre national d'information sur la biotechnologie. (2019). Dichlorure de manganèse. Base de données PubChem. CID = 24480. Récupéré de: pubchem.ncbi.nlm.nih.gov
- WebConsultas Healthcare, S.A. (2019). Minéraux: manganèse. Récupéré de: webconsultas.com


Personne n'a encore commenté ce post.