
Structure, propriétés, utilisations du chlorure de sodium (NaCl)
le chlorure de sodium, Aussi appelé sel commun ou sel de table, il s'agit d'un sel inorganique binaire du sodium de métal alcalin et du chlore halogène. C'est le plus gros composant du sel comestible et sa forme minérale est connue sous le nom d'halite. Sa formule moléculaire est NaCl, et il décrit le rapport stoechiométrique de ses ions (Na+ Cl-) et non celle d'une molécule discrète (Na-Cl)
Le chlorure de sodium est un solide cristallin blanc qui est formé par la combinaison de sodium, un métal blanc argenté, qui réagit violemment avec l'eau, et de l'élément chlore, un gaz toxique, corrosif et vert pâle..

Une partie des cristaux de NaCl est montrée dans l'image du haut. Comment est-il possible que deux éléments aussi dangereux que Na et Cldeux, un sel comestible peut se former? Premièrement, l'équation chimique pour sa formation est:
2Na (s) + Cldeux(g) => 2NaCl (s)
La réponse réside dans la nature de la liaison dans NaCl. Étant ionique, les propriétés de Na+ et Cl- sont diagonalement différents de leurs atomes neutres.
Le sodium est un élément vital, mais sous sa forme ionique. Puis un+ est le principal cation extracellulaire avec une concentration d'environ 140 mEq / l, et avec ses anions compagnons, Cl- et le HCO3- (bicarbonate), sont principalement responsables de la valeur de l'osmolarité et du volume extracellulaire.
En outre, le Na+ il est responsable de la génération et de la conduction de l'influx nerveux dans les axones neuronaux, ainsi que de l'initiation de la contraction musculaire.
Le NaCl est utilisé depuis l'Antiquité pour aromatiser les aliments et conserver la viande, en raison de sa capacité à tuer les bactéries et à prévenir la détérioration..
Il est également nécessaire pour la production d'hydroxyde de sodium (NaOH) et de chlore moléculaire (Cldeux), en faisant réagir NaCl avec de l'eau sous hydrolyse:
2HdeuxO (l) + 2 NaCl (s) => 2NaOH (aq) + Cldeux(g) + Hdeux(g)
Dans la cathode (-) accumuler le Hdeux (g) et NaOH. Pendant ce temps, dans l'anode (+) le Cl s'accumuledeux (g). L'hydroxyde de sodium est utilisé dans la fabrication de savons et le chlore dans la fabrication de plastique PVC.
Index des articles
- 1 Structure du chlorure de sodium
- 1.1 Cellule unitaire
- 2 propriétés
- 2.1 Formule moléculaire
- 2.2 Poids moléculaire
- 2.3 Description physique
- 2.4 Couleur
- 2.5 Saveur
- 2.6 Point d'ébullition
- 2.7 Point de fusion
- 2.8 Solubilité dans l'eau
- 2.9 Solubilité dans les solvants organiques
- 2.10 Densité
- 2.11 Pression de vapeur
- 2.12 Stabilité
- 2.13 Décomposition
- 2.14 Viscosité
- 2.15 Corrosion
- 2,16 pH
- 3 utilisations
- 3.1 Dans les aliments
- 3.2 Utilisations industrielles
- 3.3 À la maison
- 3.4 Autres utilisations
- 3.5 Utilisations thérapeutiques
- 4 Toxicité
- 4.1 Ingestion
- 4.2 Irritation et contact physique
- 5 Références
Structure du chlorure de sodium
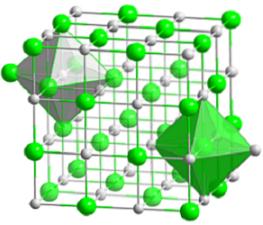
L'image du haut représente la structure cubique compacte du chlorure de sodium. Les volumineuses sphères vertes correspondent aux anions Cl-, tandis que les blancs, aux cations Na+. Notez comment le cristal de NaCl est constitué d'un réseau d'ions arrangés par leurs interactions électrostatiques dans un rapport 1: 1..
Bien que des barres soient représentées sur l'image, les liaisons ne sont pas covalentes mais ioniques. L'utilisation de barres est utile pour afficher la géométrie de coordination autour d'un ion. Par exemple, dans le cas de NaCl, chaque Na+ est entouré de six Cl- (octaèdre blanc), et chaque Cl- sur six Na+ (octaèdre vert).
Par conséquent, il a une coordination (6,6) dont les nombres indiquent combien de voisins entourent chaque ion. Le nombre sur la droite indique les voisins du Na+, tandis que celui de gauche, ceux du Cl-.
D'autres représentations omettent l'utilisation de barres pour mettre en évidence les trous octaédriques dans la structure, qui résultent de l'espace interstitiel entre six anions Cl.- (ou Na cations+) emballé. Cet arrangement est observé dans d'autres sels inorganiques mono (MX) ou polyatomiques, et s'appelle le sel gemme.
Cellule unitaire
La cellule unitaire du sel gemme est cubique, mais quels cubes la représentent exactement dans l'image ci-dessus? Les octaèdres donnent la réponse. Les deux couvrent une cellule totale composée de quatre petits cubes.
Ces cubes ont des portions d'ions à leurs sommets, arêtes et faces. En regardant de près, un ion Na+ il est situé au centre et douze d'entre eux sur les bords. Un ion sur une arête peut être partagé par quatre cubes. Donc, il y a 4 ions Na+ (12 × 1/4 + 1 = 4).
Pour les ions Cl-, huit sont situés aux sommets et six aux arêtes. Comme les ions positionnés aux sommets partagent l'espace avec huit autres cubes, et aux bords avec six, nous avons 4 ions Cl- (8 × 1/8 + 6 × 1/2 = 4).
Le résultat ci-dessus est interprété comme suit: dans la maille unitaire de NaCl, il y a quatre cations Na+ et quatre anions Cl-; proportion conforme à la formule chimique (un Na+ pour chaque Cl-).
Propriétés
Formule moléculaire
NaCl.
Poids moléculaire
58,44 g / mol.
Description physique
Un solide cristallin.
Couleur
Cristaux incolores transparents ou poudre cristalline blanche.
Goût
Salé.
Point d'ébullition
2,575ºF à 760 mmHg.
1 465 ºC.
Point de fusion
1 474 ºF (800,7 ºC).
Le point d'ébullition et le point de fusion reflètent la chaleur nécessaire pour surmonter l'énergie du réseau cristallin. Par conséquent, ces mesures confirment le caractère ionique du NaCl..
Solubilité dans l'eau
Supérieur ou égal à 100 mg / ml à 68 ° F.
36,0 g / 100 ml à 25 ° C.
Il s'agit en fait d'un sel hygroscopique, qui retient l'humidité de l'environnement.
Solubilité dans les solvants organiques
0,065 g / 100 ml d'éthanol à 25 ° C; 10 g / 100 g de glycérol à 25 ° C; 2,15 g / 100 mL d'ammoniaque liquide à 40 ° C; 1,4 g / 100 ml de méthanol à 25 ° C; 7,15 g / 100 d'éthylène glycol à 25 ° C et 5,21 g / 100 g d'acide formique à 25 ° C.
Densité
2,165 g / cm3 à 77 ºC.
La pression de vapeur
1 mmHg à 1589 ° F.
Stabilité
Stable dans les conditions de stockage recommandées.
Décomposition
Lorsqu'il est chauffé à des températures élevées, il se décompose, émettant de l'acide chlorhydrique et des vapeurs d'oxyde disodique..
Viscosité
Viscosité des solutions saturées 1,93 mPa-s.
Corrosion
Il est corrosif pour de nombreux métaux.
pH
6,7 à 7,3 en solution aqueuse.
Applications
Dans la nourriture
-Le chlorure de sodium est utilisé depuis l'Antiquité pour améliorer le goût des aliments et les conserver. Saler la viande est un moyen de la préserver de l'action bactérienne, car elle retarde la dégradation des protéines.
-En revanche, le sel augmente l'osmolarité autour de la viande, ce qui provoque l'absorption par osmose de l'eau de la bactérie, provoquant son élimination.
Usages industriels
Industrie alimentaire
-Dans l'industrie alimentaire, le sel est utilisé comme exhausteur de goût, additif de contrôle de fermentation, agent de contrôle de texture et révélateur de couleur. Par exemple, du sel est ajouté pour faire ressortir la couleur du bacon, du jambon et d'autres produits carnés..
-Le sel sert de liant dans la fabrication des saucisses. Contribue à la formation d'un gel liant composé de viande, de graisse et d'humidité.
-Dans le traitement de la farine pour la fabrication du pain, du sel est ajouté pendant la cuisson pour contrôler le taux de levée de la pâte à pain. Il est également utilisé pour renforcer le gluten et comme exhausteur de goût, ainsi que comme garniture dans les produits de boulangerie.
-Il est utilisé dans la fabrication de céréales pour petit-déjeuner, de farines mélangées ou préparées, de frites, d'aliments pour chiens et chats, etc..
Synthèse de produits chimiques
-Le chlorure de sodium est utilisé comme matière première dans la production d'hydroxyde de sodium et de chlore, qui, à leur tour, sont utiles dans de nombreuses industries chimiques.
-Le sel est utilisé dans le traitement de divers métaux, par exemple l'aluminium, le cuivre, l'acier et le vanadium. Il est également utilisé pour fabriquer du chlorate de sodium, qui est ensuite utilisé dans la synthèse du dioxyde de chlore, un agent de blanchiment à base d'oxygène. Le dioxyde de chlore est moins nocif pour l'environnement que les autres agents de blanchiment.
Dans l'industrie du cuir
-Le sel est utilisé pour inhiber l'action bactérienne à l'intérieur de la peau, ainsi que pour aider à sa réhydratation.
Dans l'industrie textile
-Le sel est utilisé comme mordant dans la teinture des tissus. Il est utilisé comme solution de rinçage à la saumure pour éliminer les contaminants organiques et pour créer une charge positive sur la surface des tissus qui permet le collage de colorants chargés négativement.
Dans l'industrie pétrolière
-Dans l'exploration pétrolière et gazière, le sel est un composant important des fluides de forage de puits. Il est utilisé pour floculer et augmenter la densité des liquides de forage, ce qui permet de s'affranchir des fortes pressions de gaz dans les puits à atteindre. De plus, le sel maintient la saturation du liquide de forage.
-Le sel aide à compacter le sol sur lequel les routes sont construites. Réduit les déplacements souterrains causés par les changements d'humidité et le trafic automobile.
À la maison
Le sel a été utilisé en frottant les surfaces de nettoyage, les casseroles et les poêles. Aussi dans la prévention des moisissures et comme détachant. Il est également utilisé dans de nombreuses marques de shampoing et de dentifrice..
Autres utilisations
Sur les routes
-En prévision des chutes de neige, les routes sont recouvertes de saumure, ce qui empêche la glace de se lier à la surface de la route. Pour la décongélation, un mélange de saumure et de sel est utilisé, et parfois d'autres composants chimiques tels que le magnésium ou le chlorure de calcium sont ajoutés. L'utilisation de sel et de saumure n'est pas efficace à des températures inférieures à -10 ºC.
L'ajout de sel produit une diminution du point cryoscopique, propriété colligative des solutions, empêchant ainsi la formation de glace d'une certaine manière..
-En raison de son état hygroscopique, le sel est utilisé comme déshydratant bon marché.
Dans les résines utilisées pour adoucir l'eau
L'eau dure contient des ions calcium et magnésium qui entravent l'action du savon et provoquent des dépôts de matières alcalines sur divers équipements et tuyaux. Dans l'adoucissement de l'eau, des résines échangeuses d'ions sont utilisées. Le sel est utilisé dans la préparation et la régénération des résines.
Dans les extincteurs
Le chlorure de sodium est utilisé dans les extincteurs pour lutter contre les incendies dans lesquels des métaux combustibles sont présents, tels que le magnésium, le potassium, le sodium et les alliages NK..
Le sel agit comme un dissipateur de chaleur et forme également une croûte qui restreint l'accès de l'oxygène au feu..
Dans les verres
Les cristaux de chlorure de sodium sont utilisés dans les composants optiques tels que les fenêtres et les prismes, en particulier pour la lumière infrarouge. Cependant, comme le sel est très hygroscopique, il se produit une sorte de givre qui recouvre les lentilles. Pour cette raison, les lentilles en chlorure de sodium ont été remplacées par des lentilles en séléniure de zinc (ZnSe)..
Utilisations thérapeutiques
Compensez le manque de sels dans le corps
-Quand il y a une déplétion corporelle de Na+, doit être remplacé pour maintenir l'osmolarité extracellulaire, la conduction nerveuse et la contraction musculaire.
-Le NaCl est utilisé dans le traitement et la prévention des carences en sodium et en chlore, résultant d'une transpiration excessive lors d'une exposition à des températures élevées. Il est également utilisé dans une diurèse excessive ou une restriction excessive de l'apport salin.
-L'administration parentérale d'une solution de NaCl à 045% est utilisée dans la gestion du diabète hyperosmolaire. Il remplit une fonction de réhydratation et sert à évaluer l'état de la fonction rénale.
-Injections de solutions hypertoniques, avec une concentration de NaCl supérieure à 0,9% p / v,
-Ils sont utilisés en cas d'épuisement sévère en Na+, étant une restauration de l'ion essentiel. Cette hyponatrémie peut être la conséquence d'un traitement avec des électrolytes libres ou avec une concentration de Na+.
L'hyponatrémie peut également être causée par une consommation excessive d'eau, non contrôlée par une fonction rénale insuffisante..
Dans les traitements et utilisations non conventionnels
-Les solutions d'inhalation de NaCl sont utilisées pour diluer les médicaments utilisés pendant le processus de nébulisation. Il est également utilisé pour le lavage et l'irrigation de la trachée. Solution saline à 0,9% utilisée dans les vaporisateurs nasaux.
-Des solutions de NaCl à 20% sont utilisées pour l'installation transabdominale intra-amniotique, induisant ainsi un avortement tardif au cours du deuxième trimestre de la grossesse..
-Le chlorure de sodium peut être utilisé comme antiseptique local. Grâce à sa capacité osmotique, il est capable de déshydrater un large spectre de virus et de bactéries à l'état non spuré; par conséquent, il est utilisé comme antiseptique douloureux pour désinfecter les plaies.
Toxicité
Ingestion
Il n'a un effet néfaste sur la santé que si l'apport est élevé et pendant une longue période. Dans ces circonstances, une hypernatrémie se produirait avec l'augmentation conséquente du volume extracellulaire qui conduirait à une hypertension artérielle..
Irritation et contact physique
Il n'a un effet toxique que si l'inhalation est très élevée. Un contact excessif avec la peau peut la dessécher. Enfin, il provoque une irritation momentanée au contact des yeux.
Les références
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition., P. 84, 90, 93, 263). Mc Graw Hill.
- Whitten, Davis, Peck et Stanley. Chimie. (8e éd.). Apprentissage CENGAGE, p. 482-483.
- Chlorure de sodium. (2018). Chlorure de sodium: avantages, utilisations, propriétés, risques. Tiré de: chlorure de sodium.org
- PubChem. (2018). Chlorure de sodium. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Wikipédia. (2018). Chlorure de sodium. Tiré de: en.wikipedia.org
- Éléments américains. (2018). Chlorure de sodium. Tiré de: americanelements.com



Personne n'a encore commenté ce post.