
Structure, utilisations, propriétés du chlorure ferreux (FeCl2)

le chlorure ferreux est un solide inorganique formé par l'union d'un cation Fedeux+ et deux anions chlorure Cl-. Sa formule chimique est FeCldeux. Il a tendance à absorber l'eau de l'environnement. L'un de ses hydrates est le tétrahydrate de FeCldeux•4HdeuxOu qui est un solide verdâtre.
Il est à noter qu'il est très soluble dans l'eau et a tendance à s'oxyder facilement en présence d'air, formant du chlorure ferrique FeCl.3. Parce qu'il est facilement oxydable et donc capable d'agir comme un réducteur, il est largement utilisé dans les laboratoires de recherche chimique et biologique..

Le chlorure ferreux a plusieurs utilisations, dont la plus importante est d'aider d'autres agents dans l'oxydation des boues issues du traitement des eaux usées ou des eaux usées. Il est également utilisé dans le processus de revêtement de fer des métaux et a certaines utilisations dans l'industrie pharmaceutique..
L'utilisation de FeCl a également été expérimentéedeux dans la récupération de métaux précieux à partir de catalyseurs usés trouvés dans les tuyaux d'échappement des véhicules fonctionnant à l'essence ou au diesel.
Il est utilisé dans l'industrie textile pour fixer les couleurs de certains types de tissus.
Index des articles
- 1 Structure
- 2 Nomenclature
- 3 propriétés
- 3.1 État physique
- 3.2 Poids moléculaire
- 3.3 Point de fusion
- 3.4 Point d'ébullition
- 3.5 Poids spécifique
- 3.6 Solubilité
- 3.7 Autres propriétés
- 4 Obtention
- 5 utilisations
- 5.1 Dans la coloration des tissus
- 5.2 Dans le traitement des eaux usées
- 5.3 Dans les études chimiques
- 5.4 Dans les études biochimiques
- 6 Références
Structure
Le chlorure ferreux est composé d'un ion ferreux Fedeux+ et deux ions chlorure Cl- rejoint par des liaisons ioniques.
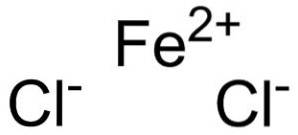
Ion ferreux Fedeux+ a la structure électronique suivante:
1sdeux, 2 sdeux 2 P6, 3 sdeux 3p6 3d6, 4 s0
où on peut voir qu'il a perdu deux électrons de la coque 4s.
Cette configuration n'est pas très stable, et pour cette raison elle a tendance à s'oxyder, c'est-à-dire à perdre un autre électron, cette fois de la couche 3d, formant l'ion Fe.3+.
De son côté, l'ion chlorure Cl- a la structure électronique suivante:
1sdeux, 2 sdeux 2 P6, 3 sdeux 3p6
où vous pouvez voir qu'il a acquis un électron supplémentaire dans la coque 3p, le complétant. Cette configuration est très stable car toutes les couches électroniques sont complètes.
Nomenclature
- Chlorure ferreux
- Chlorure de fer (II)
- Dichlorure de fer
- Chlorure ferreux tétrahydraté: FeCldeux•4HdeuxOU ALORS
Propriétés
État physique
Solide incolore à vert pâle, cristaux.
Poids moléculaire
126,75 g / mol
Point de fusion
674 ºC
Point d'ébullition
1023 ºC
Poids spécifique
3.16 à 25 ºC / 4 ºC
Solubilité
Très soluble dans l'eau: 62,5 g / 100 mL à 20 ºC. Soluble dans l'alcool, l'acétone. Légèrement soluble dans le benzène. Pratiquement insoluble dans l'éther.
Autres propriétés
FeCldeux anhydre est très hygroscopique. Il absorbe facilement l'eau de l'environnement, formant une variété d'hydrates, en particulier le tétrahydrate, dans lequel pour chaque molécule de FeCldeux il y a 4 molécules de HdeuxOu attaché à ceci (FeCldeux•4HdeuxOU ALORS).
En présence d'air, il s'oxyde lentement en FeCl3. Cela signifie que l'ion Fedeux+ facilement oxydé en ion Fe3+.
S'il est chauffé en présence d'air, il forme rapidement du chlorure ferrique FeCl3 et oxyde ferrique FedeuxOU ALORS3.
FeCldeux il est corrosif pour les métaux et les tissus.
Obtention
Il est obtenu en traitant un excès de fer métal Fe avec une solution aqueuse d'acide chlorhydrique HCl à haute température..
Foi0 + 2 HCl → FeCldeux + 2 heures+
Cependant, en raison de la présence d'eau par ce procédé, le chlorure ferreux tétrahydraté FeCl est obtenu.deux•4HdeuxOU ALORS.
Pour l'obtenir anhydre (sans eau incorporée dans les cristaux), certains chercheurs ont choisi de réaliser la réaction de poudre de fer avec HCl anhydre (sans eau) dans le solvant tétrahydrofurane (THF) à une température de 5 ºC..
Le composé FeCl est obtenu de cette manièredeux•1,5THF, qui, lorsqu'il est chauffé à 80-85 ºC sous vide ou dans une atmosphère d'azote (pour éviter la présence d'eau), produit du FeCldeux anhydre.
Applications
Le chlorure ferreux a diverses utilisations, généralement basées sur son pouvoir réducteur, c'est-à-dire qu'il peut être facilement oxydé. Il est utilisé par exemple dans les peintures et les revêtements, car il aide à les fixer à la surface.
Le fer est un micronutriment essentiel pour la santé humaine et animale. Il est impliqué dans la synthèse des protéines, dans la respiration et dans la multiplication des cellules.
D'où le FeCldeux il est utilisé dans les préparations pharmaceutiques. L'ion Fedeux+ en tant que tel, il est mieux absorbé que l'ion Fe3+ dans l'intestin.
Il est utilisé pour la fabrication de FeCl3. Il est utilisé en métallurgie, dans les bains de revêtement de fer, pour fournir un dépôt plus ductile.
Voici d'autres utilisations en vedette.
Dans la coloration des tissus
FeCldeux Il est utilisé comme mordant ou fixateur de colorant dans certains types de tissus. Le mordant réagit chimiquement et se lie simultanément au colorant et au tissu, formant un composé insoluble dessus..
De cette manière, le colorant reste fixé au tissu et sa couleur s'intensifie..
Dans le traitement des eaux usées
FeCldeux utilisé dans les stations d'épuration ou d'épuration des eaux usées (eaux usées).
Dans cette application, le chlorure ferreux participe à l'oxydation des boues, à travers un processus appelé oxydation de Fenton. Cette oxydation provoque la décomposition des flocs de boue et permet la libération de l'eau qui y est fortement liée..

Les boues peuvent ensuite être séchées et éliminées de manière écologique. L'utilisation de chlorure ferreux permet de réduire les coûts du procédé.
Il a également été récemment proposé de l'utiliser pour réduire la formation de sulfure d'hydrogène ou d'hydrogène sulfuré dans ces eaux usées..
De cette manière, la corrosion produite par ce gaz ainsi que les odeurs désagréables seraient réduites..
Dans les études chimiques
En raison de ses propriétés réductrices (le contraire de l'oxydant), FeCldeux Il est largement utilisé dans diverses enquêtes dans les laboratoires de chimie, de physique et d'ingénierie.
Certains scientifiques ont utilisé des vapeurs de chlorure ferreux pour extraire des métaux précieux tels que le platine, le palladium et le rhodium des catalyseurs usés dans les véhicules à essence ou diesel..
Ces catalyseurs sont utilisés pour éliminer les gaz nocifs pour l'homme et l'environnement. Ils sont situés dans le tuyau d'échappement des voitures et des camions fonctionnant à l'essence ou au diesel.

Après un certain temps, le convertisseur catalytique du véhicule s'use et perd de son efficacité et doit être remplacé. Le catalyseur usé est jeté et des efforts sont en cours pour récupérer les métaux précieux qu'il contient..

Selon les chercheurs, ces métaux formaient des alliages magnétiques avec le fer en chlorure ferreux..
Les alliages pourraient être extraits avec des aimants, puis les métaux précieux récupérés par des méthodes bien connues..
Dans les études biochimiques
Pour posséder le cation Fedeux+, qui est un micronutriment important chez l'homme et certains animaux, FeCldeux utilisé dans les études de biochimie et de médecine.
Certaines études ont montré que le chlorure ferreux améliore l'efficacité fongicide du plasma d'argon froid..
Le plasma froid est une technologie utilisée pour la stérilisation des surfaces et des instruments médicaux. Il est basé sur la formation de radicaux hydroxyles OH · à partir de l'humidité de l'environnement. Ces radicaux réagissent avec la paroi cellulaire du microorganisme et provoquent sa mort.
Dans cette enquête, le FeCldeux amélioré l'effet du plasma froid et accéléré l'élimination d'un champignon résistant à d'autres méthodes de désinfection.
Certains scientifiques ont découvert que l'utilisation du FeCldeux permet d'augmenter le rendement des réactions pour obtenir du glucose à partir de la bagasse de canne à sucre.
Dans ce cas, étant le Fedeux+ micro-élément essentiel pour la santé humaine, sa présence à l'état de traces dans le produit n'affecterait pas l'homme.
Les références
- Fukuda, S. et coll. (2019). Le chlorure ferreux et le sulfate ferreux améliorent l'efficacité fongicide du plasma d'argon atmosphérique froid sur les pullulans d'Aureobasidium mélanisés. J Biosci Bioeng, 2019, 128 (1): 28-32. Récupéré de ncbi.clm.nih.gov.
- Ismal, O.E. et Yildirim, L. (2019). Mordants métalliques et biomordants. Dans L'impact et les perspectives de la chimie verte pour la technologie textile. Chapitre 3, p. 57-82. Récupéré de sciencedirect.com.
- Zhang, W. et coll. (2019). Co-catalyse du chlorure de magnésium et du chlorure ferreux pour les xylo-oligosaccharides et la production de glucose à partir de la bagasse de canne à sucre. Bioresour Technol 2019, 291: 121839. Récupéré de ncbi.nlm.nih.gov.
- Zhou, X. et coll. (2015). Rôle du fer indigène dans l'amélioration de la déshydratation des boues par peroxydation. Rapports scientifiques 5: 7516. Récupéré de ncbi.nlm.nih.gov.
- Rathnayake, D. et coll. (2019). Contrôle du sulfure d'hydrogène dans les égouts en catalysant la réaction avec l'oxygène. Science de l'environnement total 689 (2019) 1192-1200. Récupéré de ncbi.nlm.nih.gov.
- Taninouchi, Y. et Okabe, T.H. (2018). Récupération des métaux du groupe du platine à partir de catalyseurs usés à l'aide d'un traitement à la vapeur de chlorure de fer. Metall et Materi Trans B (2018) 49: 1781. Récupéré de link.springer.com.
- NOUS. Bibliothèque nationale de médecine. (2019). Chlorure ferreux. Récupéré de: pubchem.ncbi.nlm.nih.gov.
- Aresta, M. et coll. (1977). Oxydation du fer (0) par le chlorure d'hydrogène dans le tétrahydrofurane: un moyen simple de chlorure de fer anhydre (II). Inorganic Chemistry, volume 16, n ° 7, 1977. Récupéré de pubs.acs.org.
- Cotton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley et fils.



Personne n'a encore commenté ce post.