
Propriétés, risques et utilisations du chromate de potassium (K2CrO4)
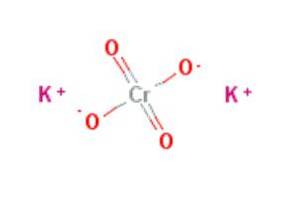
le chromate de potassium est un composé inorganique de formule KdeuxCrO4, caractérisé en ce qu'il est un puissant agent oxydant. Il est préparé en traitant le bichromate de potassium avec de l'hydroxyde de potassium selon la réaction: KdeuxCrO7 + 2KOH → 2KdeuxCrO4 + HdeuxOU ALORS.
En tant que composé avec un profil relativement unique, le chromate de potassium a un certain nombre d'utilisations dans des contextes industriels et scientifiques. Cependant, en raison de sa toxicité, son exposition devrait être limitée (JACOBS, 2015).
Index des articles
- 1 Propriétés physiques et chimiques
- 2 Réactivité et dangers
- 3 utilisations
- 4 Références
Proprietes physiques et chimiques
Le chromate de potassium sont des cristaux orthorhombiques de couleur jaunâtre qui n'ont pas d'arôme caractéristique et qui ont un goût amer désagréable (National Center for Biotechnology Information, 2017).

Son poids moléculaire est de 194,19 g / mol et sa densité de 2,7320 g / ml. Il a un point de fusion de 968 ° C et un point d'ébullition de 1000 ° C.
Le composé est insoluble dans l'alcool et très soluble dans l'eau, pouvant dissoudre 62,9 grammes pour 100 ml de solvant à 20 ° C (Royal Society of Chemistry, 2015).
Réactivité et dangers
Les agents oxydants, tels que le chromate de potassium, peuvent réagir avec les agents réducteurs pour générer de la chaleur et des produits qui peuvent être gazeux (provoquant la pressurisation des récipients fermés).
Les produits peuvent être capables de réactions supplémentaires (telles que la combustion dans l'air). La réduction chimique des matériaux de ce groupe peut être rapide voire explosive, mais nécessite souvent une initiation (chaleur, étincelle, catalyseur, ajout d'un solvant).
Les mélanges explosifs d'agents oxydants inorganiques avec des agents réducteurs restent souvent inchangés pendant de longues périodes si l'initiation est évitée. De tels systèmes sont généralement des mélanges de solides, mais peuvent impliquer n'importe quelle combinaison d'états physiques. Certains agents oxydants inorganiques sont des sels métalliques solubles dans l'eau..
La dissolution diminue mais n'annule pas le pouvoir oxydant de tels matériaux. Les composés organiques, en général, ont un certain pouvoir réducteur et peuvent en principe réagir avec des composés de cette classe.
La réactivité réelle varie considérablement avec l'identité du composé organique. Les agents oxydants inorganiques peuvent réagir violemment avec les métaux actifs, les cyanures, les esters et les thiocyanates.
Le complexe constitue une menace pour l'environnement. Des mesures immédiates doivent être prises pour en limiter la propagation. Lorsqu'il est utilisé n'importe où, dans n'importe quel but, le chromate de potassium nécessite un confinement et une élimination efficaces pour empêcher tout ruissellement ou fuite dans l'environnement..
De plus, le chromate de potassium a la capacité d'augmenter l'intensité d'un incendie si le produit chimique entre en contact avec des matériaux combustibles. Le composé émet des fumées de chrome toxiques lorsqu'il est chauffé (POTASSIUM CHROMATE, 2016).
Le chromate de potassium est très corrosif et est un puissant agent oxydant. Il affecte principalement le nez, la gorge et les poumons, provoquant des ulcérations, un essoufflement, une bronchite, une pneumonie et de l'asthme, mais il peut également affecter le tractus gastro-intestinal, le foie, les reins et le système immunitaire..
Cette substance est un cancérogène connu pour l'homme et est associée à un risque accru de développer un cancer du poumon et un cancer de la cavité nasosinusienne (Potassium Chromate, 2016).
Son caractère inodore devient problématique lorsqu'il a été exposé à ce produit chimique en raison de sa toxicité. Dans de nombreux cas, vous ne savez peut-être pas que vous avez inhalé du chromate de potassium..
De plus, l'inhalation de ce produit chimique présente plusieurs risques. Les symptômes comprennent la nausée, les vomissements, les douleurs abdominales, la sensation de brûlure, la diarrhée, le choc ou l'effondrement..
En cas de contact avec les yeux, les lentilles de contact doivent être vérifiées et retirées. Ensuite, il est nécessaire de laver immédiatement les yeux avec beaucoup d'eau pendant au moins 15 minutes avec de l'eau froide.
En cas de contact avec la peau, la zone affectée doit être rincée immédiatement à grande eau pendant au moins 15 minutes tout en retirant les vêtements et les chaussures contaminés. Couvrir la peau irritée d'un émollient.
Lavez les vêtements et les chaussures avant de les réutiliser. Si le contact est sévère, laver avec un savon désinfectant et recouvrir la peau contaminée d'une crème antibactérienne.
En cas d'inhalation, la victime doit être déplacée dans un endroit frais. Si pas de respiration, la respiration artificielle est donnée.
Si le composé est ingéré, le vomissement ne doit pas être provoqué sauf indication contraire par le personnel médical. Desserrez les vêtements serrés comme un col de chemise, une ceinture ou une cravate.
Dans tous les cas, une attention médicale doit être obtenue immédiatement (Fiche de données de sécurité Chromate de potassium, 2013).
Applications
Le chromate de potassium bénéficie d'une grande variété d'utilisations industrielles. Dans l'industrie textile, les fabricants utilisent du chromate de potassium pour tanner le cuir et teindre les vêtements et les tissus (Dye, 2017).
Il agit également comme agent oxydant dans l'industrie et en synthèse organique. Il est utilisé médicalement comme antiseptique externe ou astringent et est présent dans certains médicaments vétérinaires.
Le chromate de potassium est utilisé comme indicateur dans la détermination du chlorure par titrage avec une solution standard de nitrate d'argent. Cette méthode s'appelle la méthode de détermination du chlorure de Mohr..
Cette méthode repose sur la formation d'un précipité de chromate d'argent rouge au point final, après que tout le chlorure a précipité sous forme de chlorure d'argent blanc..
Une solution à 5% de chromate de potassium qui a été neutralisée avec du chlorure est couramment utilisée. Environ 1 mL de cet indicateur doit être utilisé pour 100 mL de volume d'échantillon (RICCA Chemical Company, 2015). Les réactions pour le titrage Mohr sont:
Ag+ + Cl- → AgCl (précipité blanc)
2 Ag+ (excès) + CrO4deux- → AgdeuxCrO4 (précipité rouge au point final)
Les références
- Dye, J. L. (1er mars 2017). ÉLÉMENT CHIMIQUE Potassium (K). Récupéré de l'encyclopédie britannica.com.
- JACOBS, J. (3 août 2015). À quoi sert le chromate de potassium? Récupéré de livestrong.com.
- Fiche signalétique Chromate de potassium. (2013, 21 mai). Récupéré de sciencelab.com.
- Centre national d'information sur la biotechnologie. (2017, 4 mars). Base de données des composés PubChem; CID = 24597. Récupéré de PubChem.
- Chromate de potassium. (2016, 27 février). Récupéré de NCIt.
- CHROMATE DE POTASSIUM. (2016). Récupéré de caméochimiques.
- Société chimique RICCA. (2015). chromate de potassium. Récupéré de riccachemical.
- Société royale de chimie. (2015). Chromate de potassium. Récupéré de chemspider.com.


Personne n'a encore commenté ce post.