
Quelles sont les lois du poids de la chimie? (Exemples)
le lois de poids de la chimie Ce sont ceux qui ont montré que les masses de substances qui réagissent ne le font pas arbitrairement ou au hasard; mais en maintenant une proportion mathématique constante d'entiers ou de sous-multiples de ceux-ci, dans lesquels les atomes des éléments ne sont ni créés ni détruits.
Dans le passé, l'établissement de ces lois exigeait des efforts de raisonnement extraordinaires; car bien que cela semble trop évident maintenant, avant que les masses atomiques ou moléculaires des éléments ou des composés, respectivement, n'étaient même pas connues.

Comme on ne savait pas exactement combien égalait une mole d'atomes de chaque élément, les chimistes des 18e et 19e siècles devaient se fier aux masses réactives. Les balances analytiques rudimentaires (image du haut) ont donc été des compagnons inséparables au cours des centaines d'expériences nécessaires à l'établissement des lois de poids..
C'est pour cette raison que lorsque vous étudiez ces lois de la chimie, vous rencontrez à chaque instant des mesures de masse. Grâce à cela, en extrapolant les résultats des expériences, il a été découvert que les composés chimiques cigares sont toujours formés avec la même proportion massique de leurs éléments constitutifs.
Index des articles
- 1 Loi de conservation de la masse
- 1.1 - Expériences de Lavoisier
- 1.2 -Équilibre des équations
- 1.3 -Calculs
- 2 Loi des proportions définies
- 2.1 -Illustration de la loi
- 2.2 -Applications
- 2.3 -Calculs
- 3 Loi des proportions multiples ou loi de Dalton
- 3.1 -Calculs
- 4 Loi des proportions réciproques
- 4.1 -Exemples
- 5 Références
Loi de conservation de masse
Cette loi dit que dans une réaction chimique, la masse totale des réactifs est égale à la masse totale des produits; tant que le système considéré est fermé et qu'il n'y a pas d'échange de masse et d'énergie avec son environnement.
Dans une réaction chimique, les substances ne disparaissent pas, mais se transforment en d'autres substances de même masse; d'où la fameuse phrase: "rien ne se crée, rien ne se détruit, tout se transforme".
Historiquement, la loi de conservation de la masse dans une réaction chimique a été proposée pour la première fois en 1756 par Mikhail Lomonsov, qui a montré les résultats de ses expériences dans son journal..
Plus tard en 1774, Antoine Levoisier, chimiste français, a présenté les résultats de ses expériences qui ont permis de l'établir; ce que certains appellent aussi la loi de Lavoisier.
-Expériences Lavoisier
Au temps de Lavoisier (1743-1794), il y avait la théorie du phlogistique, selon laquelle les corps avaient la capacité de prendre feu ou de brûler. Les expériences de Lavoisier ont permis d'écarter cette théorie.
Lavoisier a mené de nombreuses expériences de combustion de métaux. Il a soigneusement pesé les matériaux avant et après la combustion dans un récipient fermé, constatant qu'il y avait un gain de poids apparent..
Mais Lavoiser, basé sur sa connaissance du rôle de l'oxygène dans la combustion, a conclu que le gain de poids dans la combustion était dû à l'incorporation d'oxygène dans la matière en combustion. Le concept des oxydes métalliques est né.
Par conséquent, la somme des masses des métaux soumis à la combustion et de l'oxygène est restée inchangée. Cette conclusion a permis l'établissement de la loi de conservation de la masse.
-Équation d'équation
La loi de conservation des masses a établi la nécessité d'équilibrer les équations chimiques, garantissant que le nombre de tous les éléments qui participent à une réaction chimique, à la fois en tant que réactifs ou en tant que produits, est exactement le même..
Il s'agit d'une exigence essentielle pour la précision des calculs stœchiométriques à effectuer..
-Calculs
Taupes d'eau
Combien de moles d'eau peuvent être produites lors de la combustion de 5 moles de méthane en excès d'oxygène? Montrez également que la loi de conservation de la matière est respectée..
CH4 + 2 Odeux => COdeux + 2 heuresdeuxOU ALORS
En observant l'équation équilibrée de la réaction, on conclut qu'une mole de méthane produit 2 moles d'eau.
Le problème peut être résolu directement avec une approche simple, puisque nous n'avons pas 1 mole mais 5 moles de CH4:
Moles d'eau = 5 moles de CH4(2 moles de HdeuxO / 1 mol CH4)
= 10
Ce qui équivaudrait à 180 g de HdeuxO. Également formé 5 mol ou 220 g de COdeux, qui est égal à une masse totale de 400 g de produits.
Ainsi, pour que la loi de conservation de la matière soit remplie, 400 g de réactifs doivent réagir; ni plus ni moins. Sur ces 400 g, 80 g correspondent à 5 moles de CH4 (multiplié par sa masse moléculaire de 16 g / mol), et 320 g à 10 moles d'Odeux (de même pour sa masse moléculaire de 32 g / mol).
Combustion d'un ruban de magnésium
Un ruban de magnésium de 1,50 g a été brûlé dans un récipient fermé contenant 0,80 g d'oxygène. Après combustion, il restait 0,25 g d'oxygène dans le récipient. a) Quelle masse d'oxygène a réagi? b) Quelle quantité d'oxyde de magnésium s'est formée?
La masse d'oxygène qui a réagi est obtenue par une simple différence.
Masse d'oxygène consommée = (masse initiale - masse résiduelle) oxygène
= 0,80 g - 0,25 g
= 0,55 g Odeux (à)
Selon la loi de conservation de la masse,
Masse d'oxyde de magnésium = masse de magnésium + masse d'oxygène
= 1,50 g + 0,55 g
= 2,05 g de MgO (b)
Loi des proportions définies
Joseph Louis Proust (1754-1826), chimiste français, s'est rendu compte que dans une réaction chimique, les éléments chimiques réagissent toujours dans des proportions fixes de masses pour former un composé pur spécifique; par conséquent, sa composition est constante, quelle que soit la source ou l'origine, ou comment il est synthétisé.
Proust a énoncé en 1799 la loi des proportions définies, qui stipule que: "Lorsque deux ou plusieurs éléments se combinent pour former un composé, ils le font dans un rapport de masse fixe." Ensuite, cette relation est fixe et ne dépend pas de la stratégie suivie pour la préparation du composé..
Cette loi est également connue sous le nom de loi de composition constante, qui stipule que: «Tout composé chimique à l'état de pureté contient toujours les mêmes éléments, dans une proportion constante de masse»..
-Illustration de la loi
Le fer (Fe) réagit avec le soufre (S) pour former du sulfure de fer (FeS), trois situations peuvent être notées (1, 2 et 3):
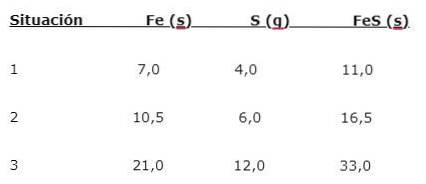
Pour trouver la proportion dans laquelle les éléments se combinent, divisez la plus grande masse (Fe) par la plus petite masse (S). Le calcul donne un rapport de 1,75: 1. Cette valeur est répétée dans les trois conditions données (1, 2 et 3), où la même proportion est obtenue bien que des masses différentes soient utilisées..
Autrement dit, 1,75 g de Fe sont combinés avec 1,0 g de S pour donner 2,75 g de FeS.
-Applications
En appliquant cette loi, il est possible de connaître exactement les masses des éléments à combiner pour obtenir une masse souhaitée d'un composé..
De cette manière, des informations peuvent être obtenues sur la masse en excès de l'un quelconque des éléments impliqués dans une réaction chimique, ou s'il y a un réactif limitant dans la réaction..
De plus, il est appliqué pour connaître la composition centésimale d'un composé, et sur la base de ce dernier, la formule d'un composé peut être établie.
Composition centésimale d'un composé
Dioxyde de carbone (COdeux) se forme dans la réaction suivante:
C + Odeux => COdeux
12 g de carbone combinent 32 g d'oxygène pour donner 44 g de dioxyde de carbone.
Donc, le pourcentage de carbone est égal à
Pourcentage de carbone = (12 g / 44 g) 100%
= 27,3%
Pourcentage d'oxygène = (32 g / 44 g) 100%
Pourcentage d'oxygène = 72,7%
En utilisant l'énoncé de la loi de composition constante, on peut noter que le dioxyde de carbone est toujours composé de 27,3% de carbone et 72,7% d'oxygène.
-Calculs
Trioxyde de soufre
Lorsque 4 g et 6 g de soufre (S) ont été mis à réagir avec de l'oxygène (O) dans différents récipients, 10 g et 15 g de trioxyde de soufre (SO3).
Pourquoi de telles quantités de trioxyde de soufre ont-elles été obtenues et pas d'autres?
Calculez également la quantité de soufre nécessaire pour se combiner avec 36 g d'oxygène et la masse de trioxyde de soufre obtenue.
Partie A)
Dans le premier récipient 4 de soufre sont mélangés à X g d'oxygène pour obtenir 10 g de trioxyde. Si la loi de conservation de la masse est appliquée, nous pouvons résoudre la masse d'oxygène combinée au soufre.
Masse d'oxygène = 10 g de trioxyde d'oxygène - 4 g de soufre.
= 6 g
Dans le récipient 2, 6 g de soufre sont mélangés à X g d'oxygène pour obtenir 15 de trioxyde de soufre.
Masse d'oxygène = 15 g de trioxyde de soufre - 6 g de soufre
= 9 g
Nous procédons ensuite au calcul des rapports O / S pour chaque conteneur:
Rapport O / S dans la situation 1 = 6 g O / 4 g S
= 1,5 / 1
Rapport O / S dans la situation 2 = 9 g O / 6 g S
= 1,5 / 1
Ce qui est conforme à ce qui est dit dans la loi des proportions définies, qui indique que les éléments se combinent toujours dans la même proportion pour former un certain composé..
Par conséquent, les valeurs obtenues sont correctes et celles qui correspondent à l'application de la loi.
Partie b)
Dans la section précédente, une valeur de 1,5 / 1 a été calculée pour le rapport O / S.
g de soufre = 36 d'oxygène (1 g de soufre / 1,5 g d'oxygène)
= 24 g
g de trioxyde de soufre = 36 g d'oxygène + 24 g de soufre
= 60 g
Chlore et magnésium
Le chlore et le magnésium sont combinés dans un rapport de 2,95 g de chlore pour chaque g de magnésium. a) Déterminer les masses de chlore et de magnésium nécessaires pour obtenir 25 g de chlorure de magnésium. b) Quelle est la composition en pourcentage du chlorure de magnésium?
Partie A)
Sur la base de la valeur 2,95 pour le rapport Cl: Mg, l'approche suivante peut être faite:
2,95 g de Cl + 1 g de Mg => 3,95 g de MgCldeux
Alors:
g de Cl = 25 g de MgCldeux (2,95 g Cl / 3,95 g MgCldeux)
= 18,67
g de Mg = 25 g de MgCldeux (1 g de Mg / 3,95 g de MgCldeux)
= 6,33
Ainsi, 18,67 g de chlore sont combinés avec 6,33 g de magnésium pour produire 25 g de chlorure de magnésium..
Partie b)
Calculez d'abord la masse moléculaire du chlorure de magnésium, MgCldeux:
Poids moléculaire MgCldeux = 24,3 g / mol + (2 35,5 g / mol)
= 95,3 g / mol
Pourcentage de magnésium = (24,3 g / 95,3 g) x 100%
= 25,5%
Pourcentage de chlore = (71 g / 95,3 g) x 100%
= 74,5%
Loi des proportions multiples ou loi de Dalton
La loi a été énoncée en 1803 par le chimiste et météorologue français John Dalton, sur la base de ses observations concernant les réactions des gaz atmosphériques.
La loi a été énoncée de la manière suivante: "Lorsque des éléments sont combinés pour donner plus d'un composé, une masse variable de l'un d'eux rejoint une masse fixe de l'autre et le premier a pour relation de nombres canoniques et indistincts".
Aussi: "Lorsque deux éléments sont combinés pour donner naissance à des composés différents, étant donné une quantité fixe de l'un d'eux, les différentes quantités de l'autre élément qui se combinent avec ladite quantité fixe pour produire les composés, sont en relation avec des entiers simples".
John Dalton a fait la première description moderne de l'atome en tant que composant des éléments chimiques, quand il a souligné que les éléments sont constitués de particules indivisibles appelées atomes..
En outre, il a postulé que les composés se forment lorsque des atomes d'éléments différents se combinent les uns avec les autres dans de simples rapports entiers..
Dalton acheva les travaux d'investigation de Proust. Il a souligné l'existence de deux oxydes d'étain, avec des pourcentages de 88,1% et 78,7% d'étain avec les pourcentages correspondants d'oxygène, respectivement 11,9% et 21,3%..
-Calculs
Eau et peroxyde d'hydrogène
Montrer que les composés eau, HdeuxO et peroxyde d'hydrogène, HdeuxOU ALORSdeux, se conformer à la loi des proportions multiples.
Poids atomiques des éléments: H = 1 g / mol et oxygène = 16 g / mol.
Poids moléculaires des composés: HdeuxO = 18 g / mol et HdeuxOU ALORSdeux = 34 g / mol.
L'hydrogène est l'élément avec une quantité fixe en HdeuxO et HdeuxOU ALORSdeux, donc les proportions entre O et H dans les deux composés seront établies.
Rapport O / H en HdeuxO = (16 g / mol) / (2 g / mol)
= 8/1
Rapport O / H en HdeuxOU ALORSdeux = (32 g / mol) / (2 g / mol)
= 16/1
Relation entre les deux proportions = (16/1) / (8/1)
= 2
Ainsi, le rapport O / H du peroxyde d'hydrogène à l'eau est de 2, un nombre entier simple. Par conséquent, le respect de la loi des proportions multiples est démontré..
Oxydes d'azote
Quelle masse d'oxygène se combine avec 3,0 g d'azote dans a) l'oxyde nitrique, NO et b) le dioxyde d'azote, NOdeux. Montrez que NON et NONdeux se conformer à la loi des proportions multiples.
Masse d'azote = 3 g
Poids atomiques: azote, 14 g / mol, et oxygène, 16 g / mol.
Calculs
Dans le NO, un atome N se combine avec 1 atome O, de sorte que la masse d'oxygène qui se combine avec 3 g d'azote peut être calculée en utilisant l'approche suivante:
g d'O = g d'azote · (PA. O / PA. N)
= 3 g (16 g / mol / 14 g / mol)
= 3,43 g O
Dans le NONdeux, un atome N se combine avec 2 atomes O, donc la masse d'oxygène combinée est:
g d'oxygène = 3 g (32 g / mol / 14 g / mol)
= 6,86 g O
Rapport O / N en NO = 3,43 g O / 3 g N
= 1 143
Rapport O / N en NOdeux = 6,86 g O / 3 g N
= 2 282
Valeur de la relation entre les proportions O / N = 2282/1143
= 2
La valeur du rapport O / N est donc 2, un nombre entier simple. Par conséquent, la loi des proportions multiples est respectée..
Loi des proportions réciproques
Cette loi formulée par Richter et Carl F. Wenzel séparément, établit que les proportions massiques de deux composés avec un élément en commun, permettent de déterminer la proportion d'un troisième composé parmi les autres éléments s'ils réagissent.
Par exemple, si vous avez les deux composés AB et CB, vous pouvez voir que l'élément commun est B.
La loi de Richter-Wenzel ou la loi des proportions réciproques dit que, sachant combien de A réagit avec B pour donner AB, et combien de C réagit avec B pour donner CB, nous pouvons calculer la masse de A qui est nécessaire pour réagir avec une masse de C pour former AC.
Et le résultat est que le rapport A: C ou A / C doit être un multiple ou sous-multiple de A / B ou C / B. Cependant, cette loi n'est pas toujours remplie, surtout lorsque les éléments présentent différents états d'oxydation..
De toutes les lois pondérales, c'est peut-être la plus «abstraite» ou la plus compliquée. Mais s'il est analysé d'un point de vue mathématique, on verra qu'il ne s'agit que de facteurs de conversion et d'annulations.
-Exemples
Méthane
Si l'on sait que 12 g de carbone réagissent avec 32 g d'oxygène pour former du dioxyde de carbone; et que, d'autre part, 2 g d'hydrogène réagissent avec 16 g d'oxygène pour former de l'eau, alors les proportions massiques C / O et H / O pour CO peuvent être estiméesdeux et HdeuxOu, respectivement.
En calculant C / O et H / O, nous avons:
C / O = 12g C / 32g O
= 3/8
H / O = 2g H / 16g O
= 1/8
L'oxygène est l'élément commun, et vous voulez savoir combien de carbone réagit avec l'hydrogène pour produire du méthane; c'est-à-dire que vous voulez calculer C / H (ou H / C). Ensuite, il est nécessaire de faire une division des proportions précédentes pour montrer si la réciprocité est remplie ou non:
C / H = (C / O) / (H / O)
Notez que de cette façon les O sont annulés et C / H reste:
C / H = (3/8) / (1/8)
= 3
Et 3 est un multiple de 3/8 (3/8 x 8). Cela signifie que 3 g de C réagissent avec 1 g de H pour donner du méthane. Mais pour pouvoir le comparer avec le COdeux, multipliez C / H par 4, ce qui est égal à 12; cela donne 12 g de C qui réagit avec 4 g de H pour former du méthane, ce qui est également vrai.
Sulfure de magnésium
Si l'on sait que 24 g de magnésium réagissent avec 2 g d'hydrogène pour former de l'hydrure de magnésium; et qu'en plus, 32 g de soufre réagissent avec 2 g d'hydrogène pour former du sulfure d'hydrogène, l'élément en commun est l'hydrogène et on veut calculer Mg / S à partir de Mg / H et H / S.
Ensuite, en calculant Mg / H et H / S séparément, nous avons:
Mg / H = 24g Mg / 2g H
= 12
H / S = 2g H / 32g S
= 1/16
Cependant, il est pratique d'utiliser S / H pour annuler le H.Par conséquent, S / H est égal à 16. Une fois cela fait, nous procédons au calcul de Mg / S:
Mg / S = (Mg / H) / (S / H)
= (12/16)
= 3/4
Et 3/4 est un sous-multiple de 12 (3/4 x 16). Le rapport Mg / S indique que 3 g de Mg réagissent avec 4 g de soufre pour former du sulfure de magnésium. Cependant, il faut multiplier Mg / S par 8 pour pouvoir le comparer avec Mg / H. Ainsi, 24 g de Mg réagissent avec 32 g de soufre pour donner ce sulfure métallique.
Chlorure d'aluminium
On sait que 35,5 g de Cl réagissent avec 1 g de H pour former HCl. De même, 27 g d'Al réagit avec 3 g de H pour former AlH3. Calculez la proportion de chlorure d'aluminium et dites si un tel composé obéit à la loi de Richter-Wenzel.
Encore une fois, nous procédons à calculer Cl / H et Al / H séparément:
Cl / H = 35,5 g Cl / 1 g H
= 35,5
Al / H = 27 g Al / 3 g H
= 9
Maintenant, Al / Cl est calculé:
Al / Cl = (Al / H) / (Cl / H)
= 9 / 35,5
≈ 0,250 ou 1/4 (en fait 0,253)
Autrement dit, 0,250 g d'Al réagit avec 1 g de Cl pour former le sel correspondant. Mais, encore une fois, Al / Cl doit être multiplié par un nombre qui lui permet d'être comparé (par commodité) avec Al / H.
Imprécisions de calcul
Al / Cl est ensuite multiplié par 108 (27 / 0,250), ce qui donne 27 g d'Al qui réagit avec 108 g de Cl. Ce n'est pas exactement le cas. Si nous prenons par exemple la valeur 0,253 fois Al / Cl, et la multiplions par 106,7 (27 / 0,253), nous aurons que 27 g d'Al réagissent avec 106,7 g de Cl; qui est plus proche de la réalité (AlCl3, avec un PA de 35,5 g / mol pour Cl).
Voici comment la loi de Richter peut commencer à faiblir en raison de la précision et de l'utilisation abusive des décimales..
Les références
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE.
- Flores, J. Química (2002). Éditorial Santillana.
- Joaquín San Frutos Fernández. (s.f.). Les lois pondérales et volumétriques. Récupéré de: encina.pntic.mec.es
- Toppr. (s.f.). Lois de la combinaison chimique. Récupéré de: toppr.com
- Brillant. (2019). Lois de la combinaison chimique. Récupéré de: brilliant.org
- Chimie LibreTexts. (2015, 15 juillet). Lois chimiques fondamentales. Récupéré de: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (18 janvier 2019). Loi de conservation de la masse. Récupéré de: thinkco.com


Personne n'a encore commenté ce post.