
Structure, propriétés et utilisations du deutérium
le deutérium est l'une des espèces isotopiques de l'hydrogène, représentée par D ou deuxH. En outre, il a été appelé hydrogène lourd, car sa masse est deux fois celle du proton. Un isotope est une espèce qui provient du même élément chimique, mais dont le nombre de masse est différent de celui-ci.
Cette distinction est due à la différence de nombre de neutrons dont il dispose. Le deutérium est considéré comme un isotope stable et peut être trouvé dans les composés d'hydrogène d'origine naturelle, bien qu'en proportion assez faible (moins de 0,02%).
Compte tenu de ses propriétés, très similaires à celles de l'hydrogène ordinaire, il peut remplacer l'hydrogène dans toutes les réactions auxquelles il participe, devenant des substances équivalentes..
Pour cette raison et d'autres, cet isotope a un grand nombre d'applications dans différents domaines de la science, devenant l'un des plus importants.
Index des articles
- 1 Structure
- 1.1 Quelques faits sur le deutérium
- 2 propriétés
- 3 utilisations
- 4 Références
Structure
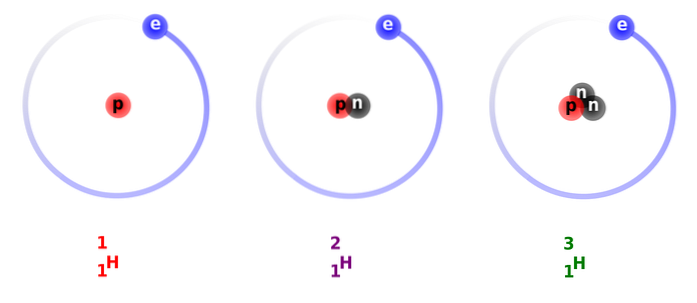
La structure du deutérium est constituée principalement par un noyau qui a un proton et un neutron, avec un poids ou une masse atomique d'environ 2 014 g.
De même, cet isotope doit sa découverte à Harold C.Urey, chimiste américain, et à ses collaborateurs Ferdinand Brickwedde et George Murphy, en 1931..
Dans l'image ci-dessus, vous pouvez voir la comparaison entre les structures des isotopes de l'hydrogène, qui existe sous forme de protium (son isotope le plus abondant), de deutérium et de tritium, ordonnés de gauche à droite.
La préparation du deutérium à l'état pur a été réalisée avec succès pour la première fois en 1933, mais depuis les années 1950, une substance en phase solide a été utilisée et a démontré sa stabilité, appelée deutérure de lithium (LiD), pour remplacer le deutérium et le tritium dans un grand nombre de réactions chimiques.
En ce sens, l'abondance de cet isotope a été étudiée et il a été observé que sa proportion dans l'eau peut varier légèrement selon la source à partir de laquelle l'échantillon est prélevé..
De plus, des études de spectroscopie ont déterminé l'existence de cet isotope sur d'autres planètes de cette galaxie..
Quelques faits sur le deutérium
Comme indiqué ci-dessus, la différence fondamentale entre les isotopes de l'hydrogène (qui sont les seuls à avoir été nommés de manière différente) réside dans leur structure, car le nombre de protons et de neutrons dans une espèce lui confère ses propriétés chimiques..
D'autre part, le deutérium existant à l'intérieur des corps stellaires est éliminé plus rapidement qu'il n'est originaire.
De plus, on considère que d'autres phénomènes de la nature n'en forment qu'une infime quantité, de sorte que sa production continue de susciter de l'intérêt aujourd'hui..
De même, une série d'enquêtes a révélé que la grande majorité des atomes qui ont été formés à partir de cette espèce sont originaires du Big Bang; c'est la raison pour laquelle sa présence est remarquée sur de grandes planètes comme Jupiter.
Comme le moyen le plus courant d'obtenir cette espèce dans la nature est de la trouver en combinaison avec de l'hydrogène sous forme de protium, la relation établie entre la proportion des deux espèces dans différents domaines scientifiques continue de susciter l'intérêt de la communauté scientifique. comme l'astronomie ou la climatologie.
Propriétés
- C'est un isotope dépourvu de caractéristiques radioactives; c'est-à-dire qu'il est assez stable dans la nature.
- Il peut être utilisé pour remplacer l'atome d'hydrogène dans les réactions chimiques.
- Cette espèce présente un comportement différent de l'hydrogène ordinaire dans les réactions de nature biochimique..
- Lorsque les deux atomes d'hydrogène sont remplacés dans l'eau, on obtient DdeuxOu, acquérir le nom de l'eau lourde.
- L'hydrogène présent dans l'océan qui se présente sous forme de deutérium existe à raison de 0,016% par rapport au protium.
- Dans les étoiles, cet isotope a tendance à fusionner rapidement pour donner naissance à l'hélium..
- Le DdeuxO est une espèce toxique, bien que ses propriétés chimiques soient très similaires à celles de Hdeux
- Lorsque les atomes de deutérium sont soumis au processus de fusion nucléaire à des températures élevées, de grandes quantités d'énergie sont libérées.
- Les propriétés physiques telles que le point d'ébullition, la densité, la chaleur de vaporisation, le point triple, entre autres, ont des magnitudes plus élevées dans les molécules de deutérium (Ddeux) que dans l'hydrogène (Hdeux).
- La forme la plus courante dans laquelle il se trouve est liée à un atome d'hydrogène, provoquant le deutérure d'hydrogène (HD).
Applications
En raison de ses propriétés, le deutérium est utilisé dans une grande variété d'applications dans lesquelles l'hydrogène est impliqué. Certaines de ces utilisations sont décrites ci-dessous:
- Dans le domaine de la biochimie, il est utilisé dans le marquage isotopique, qui consiste à «marquer» un échantillon avec l'isotope sélectionné pour le tracer à travers son passage à travers un système spécifique..
- Dans les réacteurs nucléaires qui effectuent des réactions de fusion, il est utilisé pour réduire la vitesse à laquelle les neutrons se déplacent sans l'absorption élevée de ceux-ci que présente l'hydrogène ordinaire..
- Dans le domaine de la résonance magnétique nucléaire (RMN), des solvants à base de deutérium sont utilisés pour obtenir des échantillons de ce type de spectroscopie sans la présence d'interférences qui se produisent lors de l'utilisation de solvants hydrogénés..
- Dans le domaine de la biologie, les macromolécules sont étudiées par des techniques de diffusion neutronique, où des échantillons fournis avec du deutérium sont utilisés pour réduire significativement le bruit dans ces propriétés de contraste..
- Dans le domaine de la pharmacologie, la substitution de l'hydrogène par le deutérium est utilisée en raison de l'effet isotopique cinétique généré et permet à ces médicaments d'avoir une demi-vie plus longue.
Les références
- Britannica, E. (s.f.). Deutérium. Récupéré de britannica.com
- Wikipédia. (s.f.). Deutérium. Récupéré de en.wikipedia.org
- Chang, R. (2007). Chimie, neuvième édition. Mexique: McGraw-Hill.
- Hyperphysique. (s.f.). Abondance de deutérium. Récupéré de hyperphysics.phy-astr.gsu.edu
- ThoughtCo. (s.f.). Faits sur le deutérium. Récupéré de thinkco.com



Personne n'a encore commenté ce post.