
Unités d'énergie libre de Gibbs, comment la calculer, exercices résolus
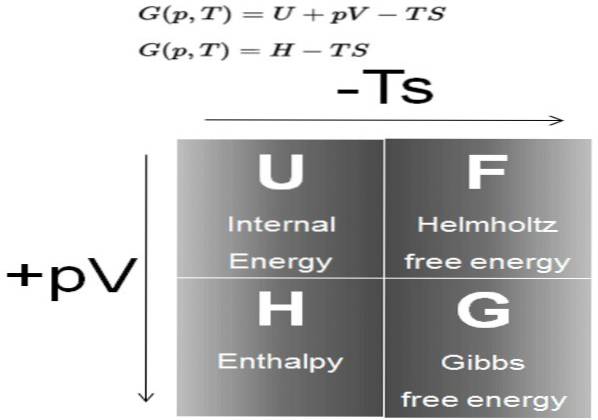
La Énergie gratuite Gibbs (communément appelé G) est un potentiel thermodynamique défini comme la différence de l'enthalpie H, moins le produit de la température T, par l'entropie S du système:
G = H - T S
L'énergie libre de Gibbs est mesurée en Joules (selon le système international), en ergs (pour le système d'unités cégésimal), en calories ou en électron-volts (pour électro Volts).
Dans les processus qui se produisent à pression et température constantes, la variation de l'énergie libre de Gibbs est ΔG = ΔH - T ΔS. Dans de tels processus, (G) représente l'énergie disponible dans le système qui peut être convertie en travail.
Par exemple, dans les réactions chimiques exothermiques, l'enthalpie diminue tandis que l'entropie augmente. Dans la fonction de Gibbs, ces deux facteurs sont contrecarrés, mais ce n'est que lorsque l'énergie de Gibbs diminue que la réaction se produit spontanément..
Donc, si la variation de G est négative, le processus est spontané. Lorsque la fonction de Gibbs atteint son minimum, le système atteint un état d'équilibre stable. En résumé, dans un processus pour lequel la pression et la température restent constantes, on peut affirmer:
- Si le processus est spontané, alors ΔG < 0
- Lorsque le système est en équilibre: ΔG = 0
- Dans un processus non spontané, G augmente: ΔG> 0.
Index des articles
- 1 Comment est-il calculé?
- 1.1 - Pas à pas
- 1.2 - Relations thermodynamiques de Maxwell
- 2 exercices résolus
- 2.1 Exercice 1
- 2.2 Exercice 2
- 2.3 Exercice 3
- 3 Références
Comment est-il calculé?
L'énergie libre de Gibbs (G) est calculée en utilisant la définition donnée au début:
G = H - T⋅S
À son tour, l'enthalpie H est un potentiel thermodynamique défini comme:
H = U + P V
- Pas à pas
Ensuite, une analyse pas à pas sera faite, pour connaître les variables indépendantes dont l'énergie de Gibbs est une fonction:
1- De la première loi de la thermodynamique nous avons que l'énergie interne U est liée à l'entropie S du système et à son volume V pour les processus réversibles à travers la relation différentielle:
dU = dQ - dW = TdS - PdV
De cette équation, il s'ensuit que l'énergie interne U est fonction des variables S et V:
U = U (S, V)
2- En partant de la définition de H et en prenant le différentiel, on obtient:
dH = dU + d (P V) = dU + VdP + PdV
3- En remplaçant l'expression de dU obtenue en (1) on a:
dH = TdS - PdV + VdP + PdV = TdS + VdP
On en conclut que l'enthalpie H dépend de l'entropie S et de la pression P, c'est-à-dire:
H = H (S, P)
4- Maintenant, le différentiel total d'énergie libre de Gibbs est calculé en obtenant:
dG = dH -TdS -SdT = TdS + VdP -TdS -SdT
Où dH a été remplacé par l'expression trouvée dans (3).
5- Enfin, en simplifiant, on obtient: dG = VdP - SdT, étant clair que l'énergie libre G dépend de la pression et de la température T comme:
G = G (P, T)
- Relations thermodynamiques de Maxwell
De l'analyse de la section précédente, il s'ensuit que l'énergie interne d'un système est fonction de l'entropie et du volume:
U = U (S, V)
Puis le différentiel de OU ALORS sera:
dU = ∂SU |V dS + ∂VU |S dV = TdS - PdV
À partir de cette expression dérivée partielle, les relations thermodynamiques dites de Maxwell peuvent être dérivées. Les dérivées partielles s'appliquent lorsqu'une fonction dépend de plus d'une variable et sont facilement calculées en appliquant le théorème de la section suivante.
La première relation de Maxwell
∂VT |S = -∂SP |V
Pour arriver à cette relation, le Théorème de Clairaut-Schwarz sur les dérivées partielles, qui indique ce qui suit:
"Les dérivées mixtes du second ordre avec les variables interchangées sont égales, tant que les fonctions à dériver sont continues et différentiables".
Deuxième relation de Maxwell
Sur la base de ce qui est montré au point 3 de la section précédente:
H = H (S, P) et dH = TdS + VdP
Il peut être obtenu:
∂PT |S = ∂SV |P
On procède de la même manière avec l'énergie libre de Gibbs G = G (P, T) et avec l'énergie gratuite de Helmholtz F = F (T, V) pour obtenir les deux autres relations thermodynamiques de Maxwell.

Les quatre relations thermodynamiques de Maxwell
1- Associé à l'énergie interne U: ∂VT |S = -∂SP |V
2- Celui obtenu à partir de l'enthalpie H: ∂PT |S = ∂SV |P
3- Lié à l'énergie de Helmholtz F: ∂TP |V = ∂VS |T
4- Lié à l'énergie libre Gibbs G: ∂TV |P = -∂PS |T
Exercices résolus
Exercice 1
Calculer la variation de l'énergie libre de Gibbs pour 2 moles de gaz idéal à une température de 300K lors d'une détente isotherme qui fait passer le système d'un volume initial de 20 litres à un volume final de 40 litres.
Solution
Rappelant la définition de l'énergie libre de Gibbs, nous avons:
G = H - T S
Alors une variation finie de F sera:
ΔG = ΔH - T ΔS, puisque ΔT = 0
Dans les gaz parfaits, l'enthalpie ne dépend que de sa température absolue, mais comme il s'agit d'un processus isotherme, alors ΔH = 0 et ΔG = - T ΔS.
Pour les gaz parfaits, le changement d'entropie d'un processus isotherme est:
ΔS = nR ln (Vdeux/ V1)
Cela s'applique au cas de cet exercice demeure:
ΔS = 2 moles x 8,314 J / (K mol) x ln (40L / 20L) = 11,53 J / K
Ensuite, nous pouvons obtenir le changement d'énergie de Helmholtz:
ΔG = - 300 K x 11,53 J / K = -3457,70 J.
Exercice 2
Tenant compte du fait que l'énergie libre de Gibbs est fonction de la température et de la pression G = G (T, P); déterminer la variation de G au cours d'un processus dans lequel la température ne change pas (isotherme) pour n moles d'un gaz parfait monoatomique.
Solution
Comme démontré ci-dessus, le changement d'énergie de Gibbs ne dépend que du changement de température T et de volume V, donc une variation infinitésimale de celle-ci est calculée en fonction de:
dG = -SdT + VdP
Mais s'il s'agit d'un processus dans lequel la température est constante alors dF = + VdP, donc une variation de pression finie ΔP conduit à un changement de l'énergie de Gibbs donné par:
ΔG = + ∫ VdP = + ∫ (n R T) dP / P = + n R T ln (ΔP)
En utilisant l'équation des gaz parfaits:
P V = n R T
Au cours d'un processus isotherme, il se produit que:
d (P V) = P dV + V dP = 0
C'est-à-dire:
dP / P = - dV / V
Ainsi, le résultat ci-dessus peut être écrit en fonction de la variation de volume ΔV:
ΔG = + ∫ VdP = + ∫ (n R T) dP / P = - ∫ (n R T) dV / V = -n R T ln (ΔV)
Exercice 3
Compte tenu de la réaction chimique suivante:
Ndeux0 (g) + (3/2) Odeux (g) ↔️ 2NONdeux (g) à la température T = 298 K
Trouvez la variation de l'énergie libre de Gibbs et, à l'aide du résultat obtenu, indiquez s'il s'agit ou non d'un processus spontané.
Solution
Voici les étapes:
- Première étape: les enthalpies de réaction
ΔHr = 2 * ΔH (NONdeux (g)) - ΔH (Ndeux0 (g)) = 2 * 33,2-81,6 = -15,2kJ / mol
- Deuxième étape: la variation d'entropie de la réaction
ΔSr = 2 * S (NONdeux (g)) - S (Ndeux0 (g)) - (3/2) S (Odeux (g)) = 2 * 240,1 - 220,1 - 1,5 * 205,2 = -47,7 J / (mol * K).
- Troisième étape: variation de la fonction Gibbs
Cette valeur déterminera l'équilibre entre l'énergie décroissante et l'entropie croissante pour savoir si finalement la réaction est spontanée ou non.
ΔGr = ΔHr - T ΔSr = -15,2 -298 * (- 47,7) = -985,4 J / mol
Comme il s'agit d'une variation négative de l'énergie de Gibbs, on peut conclure qu'il s'agit d'une réaction spontanée à la température de 298 K = 25 ºC.
Les références
- Châtaignes E. Exercices énergétiques gratuits. Récupéré de: lidiaconlaquimica.wordpress.com.
- Cengel, Y. 2012. Thermodynamique. 7e édition. Mcgraw Hill.
- Libretexts. Gibbs Free Energy. Récupéré de: chem.libretexts.org
- Libretexts. Que sont les énergies libres. Récupéré de: chem.libretexts.org
- Wikipédia. Énergie libre de Gibbs. Récupéré de: es.wikipedia.com
- Wikipédia. Énergie libre de Gibbs. Récupéré de: en.wikipedia.com



Personne n'a encore commenté ce post.