
Link Pi Comment il est formé, caractéristiques et exemples
UNE lien pi (π) est un type de liaison covalente caractérisé en empêchant le mouvement de rotation libre des atomes et en partant entre une paire d'orbitales atomiques de type pur, entre autres particularités. Il existe des liaisons qui peuvent être formées entre les atomes par leurs électrons, ce qui leur permet de construire des structures plus grandes et plus complexes: des molécules.
Ces liaisons peuvent être de différentes variétés, mais les plus courantes dans ce domaine d'étude sont les covalentes. Les liaisons covalentes, également appelées liaisons moléculaires, sont un type de liaison où les atomes impliqués partagent des paires d'électrons.
Cela peut se produire en raison du besoin des atomes de rechercher la stabilité, formant ainsi la plupart des composés connus. En ce sens, les liaisons covalentes peuvent être simples, doubles ou triples, selon la configuration de leurs orbitales et le nombre de paires d'électrons partagées entre les atomes impliqués..
C'est pourquoi il existe deux types de liaisons covalentes qui se forment entre les atomes en fonction de l'orientation de leurs orbitales: les liaisons sigma (σ) et les liaisons pi (π)..
Il est important de différencier les deux liaisons, car la liaison sigma se produit dans des liaisons simples et pi dans des liaisons multiples entre les atomes (deux électrons ou plus sont partagés).
Index des articles
- 1 Comment se forme-t-il?
- 1.1 Formation de liaisons pi dans différentes espèces chimiques
- 2 caractéristiques
- 3 exemples
- 4 Références
Comment se forme-t-il?
Afin de décrire la formation de la liaison pi, le processus d'hybridation doit d'abord être discuté, car il intervient dans certaines liaisons importantes..
L'hybridation est un processus dans lequel des orbitales électroniques hybrides sont formées; c'est-à-dire où les orbitales de sous-niveaux atomiques s et p peuvent se mélanger. Cela provoque la formation d'orbitales sp, spdeux et sp3, qui sont appelés hybrides.
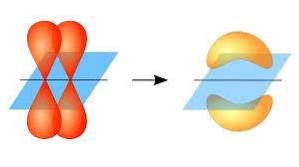
En ce sens, la formation de liaisons pi se produit grâce au chevauchement d'une paire de lobes appartenant à une orbitale atomique sur une autre paire de lobes qui se trouvent dans une orbitale faisant partie d'un autre atome..
Ce chevauchement orbital se produit latéralement, de sorte que la distribution électronique est principalement concentrée au-dessus et au-dessous du plan formé par les noyaux atomiques liés, et rend les liaisons pi plus faibles que les liaisons sigma..
Lorsqu'on parle de la symétrie orbitale de ce type d'union, il faut mentionner qu'elle est égale à celle des orbitales de type p tant qu'elle est observée à travers l'axe formé par la liaison. De plus, ces unions sont majoritairement constituées d'orbitales p..
Formation de liaisons pi dans différentes espèces chimiques
Comme les liaisons pi sont toujours accompagnées d'une ou deux liaisons supplémentaires (un sigma ou un autre pi et un sigma), il est pertinent de savoir que la double liaison qui se forme entre deux atomes de carbone (constituée d'une liaison sigma et d'une liaison pi) a une énergie de liaison inférieure à celle correspondant à deux fois la liaison sigma entre les deux.
Ceci s'explique par la stabilité de la liaison sigma, qui est supérieure à celle de la liaison pi car le chevauchement des orbitales atomiques dans cette dernière se produit de manière parallèle dans les régions au-dessus et au-dessous des lobes, accumulant la distribution électronique dans un plus chemin éloigné des noyaux atomiques.
Malgré cela, lorsque les liaisons pi et sigma sont combinées, une liaison multiple plus forte est formée que la liaison simple elle-même, ce qui peut être vérifié en observant les longueurs de liaison entre divers atomes de liaisons simples et multiples..
Certaines espèces chimiques sont étudiées pour leur comportement exceptionnel, comme les composés de coordination avec des éléments métalliques, dans lesquels les atomes centraux ne sont liés que par des liaisons pi..
Caractéristiques
Les caractéristiques qui distinguent les liaisons pi des autres types d'interactions entre les espèces atomiques sont décrites ci-dessous, à commencer par le fait que cette liaison ne permet pas le libre mouvement de rotation des atomes, comme le carbone. Pour cette raison, s'il y a rotation des atomes, la liaison se rompt..
De même, dans ces liaisons, le chevauchement entre les orbitales se produit à travers deux régions parallèles, ce qui fait qu'elles ont une plus grande diffusion que les liaisons sigma et que, pour cette raison, elles sont plus faibles..
D'autre part, comme mentionné ci-dessus, la liaison pi est toujours générée entre une paire d'orbitales atomiques pures; Cela signifie qu'il est généré entre des orbitales qui n'ont pas subi de processus d'hybridation, dans lesquels la densité des électrons est concentrée principalement au-dessus et au-dessous du plan formé par la liaison covalente..
En ce sens, entre une paire d'atomes il peut y avoir plus d'une liaison pi, toujours accompagnée d'une liaison sigma (dans les doubles liaisons).
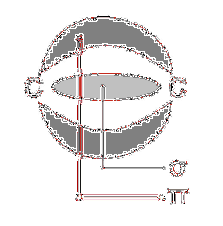
De même, il peut y avoir une triple liaison entre deux atomes adjacents, qui est formée par deux liaisons pi dans des positions qui forment des plans perpendiculaires l'un à l'autre et une liaison sigma entre les deux atomes..
Exemples
Comme indiqué précédemment, les molécules constituées d'atomes reliés par une ou plusieurs liaisons pi ont toujours des liaisons multiples; c'est-à-dire doubles ou triples.
Un exemple de ceci est la molécule d'éthylène (HdeuxC = CHdeux), qui est constituée d'une double liaison; c'est-à-dire une liaison pi et une liaison sigma entre leurs atomes de carbone, en plus des liaisons sigma entre les carbones et les hydrogènes.
De son côté, la molécule d'acétylène (H-C≡C-H) possède une triple liaison entre ses atomes de carbone; c'est-à-dire, deux liaisons pi formant des plans perpendiculaires et une liaison sigma, en plus de leurs liaisons sigma carbone-hydrogène correspondantes.
Des liaisons Pi se produisent également entre des molécules cycliques, telles que le benzène (C6H6) et ses dérivés, dont la disposition se traduit par un effet appelé résonance, qui permet à la densité électronique de migrer entre les atomes et confère, entre autres, une plus grande stabilité au composé..
Pour illustrer les exceptions mentionnées précédemment, les cas de la molécule de dicarbon (C = C, dans laquelle les deux atomes ont une paire d'électrons appariés) et le composé de coordination appelé hexacarbonyl fer (représenté par Fedeux(CO)6, qui n'est formé que par des liaisons pi entre ses atomes).
Les références
- Wikipédia. (s.f.). Liaison Pi. Récupéré de en.wikipedia.org
- Chang, R. (2007). Chimie, neuvième édition. Mexique: McGraw-Hill.
- ThoughtCo. (s.f.). Définition de pi Bond en chimie. Récupéré de thinkco.com
- Britannica, E. (s.f.). Liaison Pi. Récupéré de britannica.com
- LibreTexts. (s.f.). Obligations Sigma et Pi. Récupéré de chem.libretexts.org
- Srivastava, A. K. (2008). La chimie organique simplifiée. Récupéré de books.google.co.ve



Personne n'a encore commenté ce post.