
Propriétés à l'échelle microscopique, comptage des particules, exemples
La échelle microscopique C'est celui qui est utilisé pour mesurer des tailles et des longueurs qui ne peuvent pas être vues à l'œil nu et qui sont inférieures à un millimètre de longueur. Du plus haut au plus bas, les échelles microscopiques du système métrique sont:
- Le millimètre (1 mm), qui est un dixième de centimètre ou un millième de mètre. Dans cette échelle, nous avons l'une des plus grandes cellules du corps, qui est l'ovule, dont la taille est de 1,5 mm.
- Le dixième de millimètre (0,1 mm). C'est l'échelle de l'épaisseur ou du diamètre d'un cheveu humain.
- Le micromètre ou micron (1 μm = 0,001 mm). A cette échelle se trouvent des cellules végétales et animales et des bactéries.
Les cellules végétales sont de l'ordre de 100 μm. Les cellules animales sont dix fois plus petites, elles sont de l'ordre de 10 μm; tandis que les bactéries sont 10 fois plus petites que les cellules animales et sont de l'ordre de 1μm.
Index des articles
- 1 échelle nanométrique
- 2 Instruments pour l'observation microscopique
- 3 Propriétés microscopiques
- 3.1-La matière est un immense vide
- 4 Comment compter les particules à l'échelle microscopique?
- 4.1 -Exemple 1
- 4.2 -Exemple 2
- 5 Références
Échelle nanométrique
Il existe des mesures encore plus petites que l'échelle microscopique, mais elles ne sont pas couramment utilisées, sauf dans certains contextes particuliers. Voici quelques-unes des mesures nanométriques les plus importantes:
- Le nanomètre (1 ηm = 0,001 μm = 0,000001 mm) est un millionième de millimètre. A cette échelle se trouvent certains virus et molécules. Les virus sont de l'ordre de 10ηm et les molécules de l'ordre de 1ηm.
- L'angström (1Å = 0,1ηm = 0,0001μm = 10-7mm). Cette mesure forme l'échelle ou la taille atomique.
- Le fantomomètre (1fm = 0,00001Å = 0,000001ηm = 10-12mm). C'est l'échelle des noyaux atomiques, qui sont entre 10 000 et 100 000 fois plus petits que l'atome. Cependant, malgré sa petite taille, le noyau concentre 99,99% de la masse atomique.
- Il existe des échelles plus petites du noyau atomique, car celles-ci sont constituées de particules telles que des protons et des neutrons. Mais il y a plus: ces particules sont à leur tour constituées de particules plus fondamentales comme les quarks..
Instruments d'observation microscopique
Lorsque les objets sont entre les échelles millimétrique et micrométrique (1 mm - 0,001 mm), ils peuvent être observés avec un microscope optique.
Cependant, si les objets ou les structures sont entre nanomètres et angströms, des microscopes électroniques ou le nanoscope seront nécessaires..
En microscopie électronique, au lieu de la lumière, des électrons de haute énergie sont utilisés qui ont une longueur d'onde beaucoup plus courte que la lumière. L'inconvénient du microscope électronique est qu'il n'est pas possible d'y placer des échantillons vivants car il fonctionne sous vide..
Au lieu de cela, le nanoscope utilise la lumière laser et présente l'avantage par rapport à la microscopie électronique que les structures et les molécules d'une cellule vivante peuvent être examinées et enregistrées..
La nanotechnologie est la technologie avec laquelle les circuits, les structures, les pièces et même les moteurs sont fabriqués à des échelles allant du nanomètre à l'échelle atomique..
Propriétés microscopiques
En physique, en première approximation, le comportement de la matière et des systèmes est étudié du point de vue macroscopique. De ce paradigme, la matière est un continuum infiniment divisible; et ce point de vue est valable et adapté à de nombreuses situations de la vie quotidienne.
Cependant, certains phénomènes dans le monde macroscopique ne peuvent être expliqués que si les propriétés microscopiques de la matière sont prises en compte..
Au point de vue microscopique, la structure moléculaire et atomique de la matière est prise en compte. Contrairement à l'approche macroscopique, il existe à cette échelle une structure granulaire avec des lacunes et des espaces entre les molécules, les atomes et même en leur sein..
L'autre caractéristique du point de vue microscopique en physique est qu'un morceau de matière, aussi petit soit-il, est composé d'un nombre énorme de particules séparées les unes des autres et en mouvement continu..
-La matière est un immense vide
Dans un petit morceau de matière, la distance entre les atomes est énorme par rapport à leur taille, mais à leur tour, les atomes sont énormes par rapport à leurs propres noyaux, où 99,99% de la masse est concentrée..
Autrement dit, un morceau de matière à l'échelle microscopique est un énorme vide avec des concentrations d'atomes et de noyaux qui occupent une infime fraction du volume total. En ce sens, l'échelle microscopique est similaire à l'échelle astronomique..
Des objets macroscopiques à la découverte de l'atome
Les premiers chimistes, qui étaient les alchimistes, se sont rendu compte que les matériaux pouvaient être de deux types: purs ou composés. C'est ainsi que l'idée des éléments chimiques est arrivée.
Les premiers éléments chimiques découverts étaient les sept métaux de l'Antiquité: l'argent, l'or, le fer, le plomb, l'étain, le cuivre et le mercure. Au fil du temps, on en a découvert davantage dans la mesure où on a trouvé des substances qui ne pouvaient pas être décomposées en d'autres.
Ensuite, les éléments ont été classés en fonction de leurs propriétés et caractéristiques en métaux et non-métaux. Tous ceux qui avaient des propriétés et une affinité chimique similaires ont été regroupés dans la même colonne, et ainsi le tableau périodique des éléments a surgi..
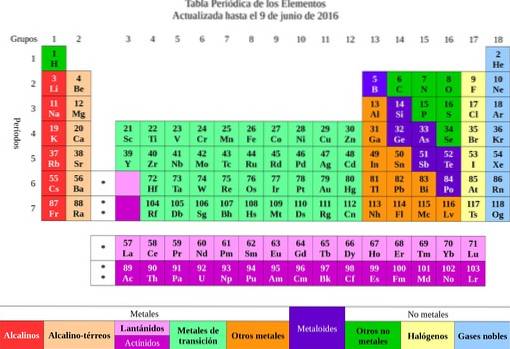
Des éléments, l'idée des atomes a été transmise, un mot qui signifie indivisible. Peu de temps après, les scientifiques ont réalisé que les atomes avaient une structure. De plus, les atomes avaient deux types de charge électrique (positive et négative).
Particules subatomiques
Dans les expériences de Rutherford dans lesquelles il a bombardé les atomes d'une fine plaque d'or avec des particules alpha, la structure de l'atome a été révélée: un petit noyau positif entouré d'électrons.
Les atomes ont continué à être bombardés avec de plus en plus de particules d'énergie et sont toujours en cours, afin de percer les secrets et les propriétés du monde microscopique à une échelle de plus en plus petite..
De cette manière, le modèle standard a été atteint, dans lequel il est établi que les vraies particules élémentaires sont celles dont les atomes sont composés. À leur tour, les atomes donnent naissance à des éléments, ceux-ci à des composés et à toutes les interactions connues (à l'exception de la gravitation). Au total, il y a 12 particules.
Ces particules fondamentales ont également leur tableau périodique. Il existe deux groupes: les particules fermioniques ½ spin et les particules bosoniques. Les bosons sont responsables des interactions. Les fermioniques ont 12 ans et sont ceux qui donnent naissance à des protons, des neutrons et des atomes.
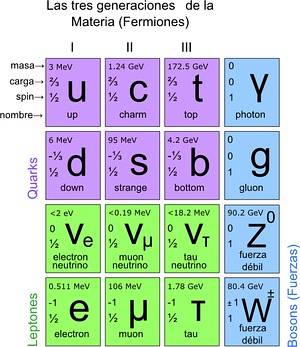
Comment compter les particules à l'échelle microscopique?
Au fil du temps, les chimistes découvraient les masses relatives des éléments à partir de mesures précises dans des réactions chimiques. Ainsi, par exemple, on pourrait déterminer que le carbone est 12 fois plus lourd que l'hydrogène..
L'hydrogène a également été déterminé comme étant l'élément le plus léger, donc cet élément s'est vu attribuer la masse relative 1.
D'autre part, les chimistes devaient connaître le nombre de particules impliquées dans une réaction, de sorte qu'aucun réactif ne soit terminé ou absent. Par exemple, une molécule d'eau nécessite deux atomes d'hydrogène et un atome d'oxygène..
De ces antécédents est né le concept de taupe. Une mole de toute substance est un nombre fixe de particules équivalent à sa masse moléculaire ou atomique en grammes. Ainsi, il a été déterminé que 12 grammes de carbone ont le même nombre de particules qu'un gramme d'hydrogène. Ce nombre est connu comme le nombre d'Avogadro: 6,02 x 10 ^ 23 particules.
-Exemple 1
Calculez le nombre d'atomes d'or dans 1 gramme d'or.
Solution
L'or est connu pour avoir un poids atomique de 197. Ces données peuvent être trouvées dans le tableau périodique et indiquent qu'un atome d'or est 197 fois plus lourd qu'un atome d'hydrogène et 197/12 = 16 416 fois plus lourd que le carbone..
Une mole d'or a 6,02 × 10 ^ 23 atomes et a le poids atomique exprimé en grammes, soit 197 grammes.
Dans un gramme d'or, il y a 1/197 mole d'or, soit 6,02 × 10 ^ 23 atomes / 197 = 3,06 x10 ^ 23 atomes d'or.
-Exemple 2
Déterminer le nombre de molécules de carbonate de calcium (CaCO3) qui sont dans 150 grammes de cette substance. Dites également combien d'atomes de calcium, combien de carbone et combien d'oxygène sont dans ce composé.
Solution
La première chose à faire est de déterminer la masse moléculaire du carbonate de calcium. Le tableau périodique indique que le calcium a un poids moléculaire de 40 g / mol, le carbone 12 g / mol et l'oxygène 16 g / mol..
Puis la masse moléculaire de (CaCO3) sera :
40 g / mol + 12 g / mol + 3 x 16 g / mol = 100 g / mol
Tous les 100 grammes de carbonate de calcium représentent 1 mole. Donc en 150 grammes, ils correspondent à 1,5 mole.
Chaque mole de carbonate contient 6,02 x 10 ^ 23 molécules de carbonate, donc dans 1,5 mole de carbonate il y a 9,03 x 10 ^ 23 molécules.
En bref, dans 150 grammes de carbonate de calcium, il y a:
- 9,03 x 10 ^ 23 molécules de carbonate de calcium.
- Atomes de calcium: 9,03 x 10 ^ 23 .
- Aussi 9,03 x 10 ^ 23 atomes de carbone
- Enfin, 3 x 9,03 x 10 ^ 23 atomes d'oxygène = 27,09 x 10 ^ 23 atomes d'oxygène.
Les références
- Biologie appliquée. Quelles sont les mesures microscopiques? Récupéré de: youtube.com
- Éducation chimique. Représentations macroscopiques, submicroscopiques et symboliques de la matière. Récupéré de: scielo.org.mx.
- García A. Cours de physique interactif. Macro-états, micro-états. Température, entropie. Récupéré de: sc.ehu.es
- La structure microscopique de la matière. Récupéré de: alipso.com
- Wikipédia. Niveau microscopique. Récupéré de: wikipedia.com



Personne n'a encore commenté ce post.