
Spectre d'absorption Absorption atomique, visible et moléculaire
UNE Spectre d'absorption C'est le produit de l'interaction de la lumière avec un matériau ou une substance dans l'un de ses états physiques. Mais la définition va au-delà d'une simple lumière visible, puisque l'interaction comprend un large segment de la gamme des longueurs d'onde et de l'énergie du rayonnement électromagnétique..
Par conséquent, certains solides, liquides ou gaz peuvent absorber des photons d'énergies ou de longueurs d'onde différentes; du rayonnement ultraviolet, suivi de la lumière visible, au rayonnement ou à la lumière infrarouge, en passant dans les longueurs d'onde des micro-ondes.

L'œil humain ne perçoit que les interactions de la matière avec la lumière visible. De même, il est capable de contempler la diffraction de la lumière blanche à travers un prisme ou un médium dans ses composantes colorées (image du haut).
Si le rayon de lumière était «capté» après avoir parcouru un matériau et analysé, on trouverait l'absence de certaines bandes de couleurs; c'est-à-dire que des rayures noires seraient observées contrastant avec son arrière-plan. C'est le spectre d'absorption, et son analyse est fondamentale en chimie analytique instrumentale et en astronomie..
Index des articles
- 1 Absorption atomique
- 1.1 Transitions et énergies électroniques
- 2 Spectre visible
- 3 Spectre d'absorption des molécules
- 3.1 Bleu de méthylène
- 3.2 Chlorophylles a et b
- 4 Références
Absorption atomique
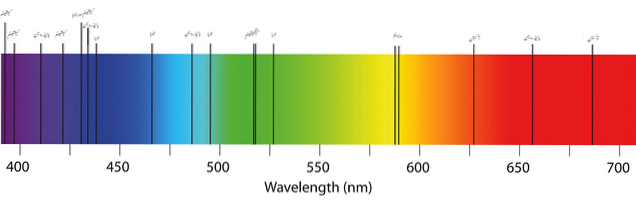
L'image du haut montre un spectre d'absorption typique des éléments ou des atomes. Notez que les bandes noires représentent les longueurs d'onde absorbées, tandis que les autres sont celles émises. Cela signifie qu'en revanche, un spectre d'émission atomique ressemblerait à une bande noire avec des bandes de couleurs émises..
Mais quelles sont ces rayures? Comment savoir en bref si les atomes absorbent ou émettent (sans introduire de fluorescence ou de phosphorescence)? Les réponses résident dans les états électroniques autorisés des atomes.
Transitions et énergies électroniques
Les électrons sont capables de s'éloigner du noyau en le laissant chargé positivement pendant qu'ils transitent d'une orbitale d'énergie inférieure à une orbitale d'énergie supérieure. Pour cela, expliqué par la physique quantique, ils absorbent des photons d'une énergie spécifique pour réaliser ladite transition électronique..
Par conséquent, l'énergie est quantifiée, et ils n'absorberont pas la moitié ou les trois quarts d'un photon, mais des valeurs de fréquence spécifiques (ν) ou des longueurs d'onde (λ).
Une fois que l'électron est excité, il ne reste pas pour un temps illimité dans l'état électronique d'énergie supérieure; libère l'énergie sous la forme d'un photon, et l'atome retourne à son état basal ou d'origine.
Selon que les photons absorbés sont enregistrés ou non, un spectre d'absorption sera obtenu; et si les photons émis sont enregistrés, alors le résultat sera un spectre d'émission.
Ce phénomène peut être observé expérimentalement si des échantillons gazeux ou atomisés d'un élément sont chauffés. En astronomie, en comparant ces spectres, la composition d'une étoile peut être connue, et même sa localisation par rapport à la Terre..
Spectre visible
Comme on peut le voir sur les deux premières images, le spectre visible comprend les couleurs du violet au rouge et toutes leurs nuances en ce qui concerne l'absorption du matériau (nuances sombres).
Les longueurs d'onde de la lumière rouge correspondent à des valeurs à partir de 650 nm (jusqu'à ce qu'elles disparaissent dans le rayonnement infrarouge). Et à l'extrême gauche, les tons violet et violet couvrent les valeurs de longueur d'onde jusqu'à 450 nm. Le spectre visible varie alors de 400 à 700 nm environ.
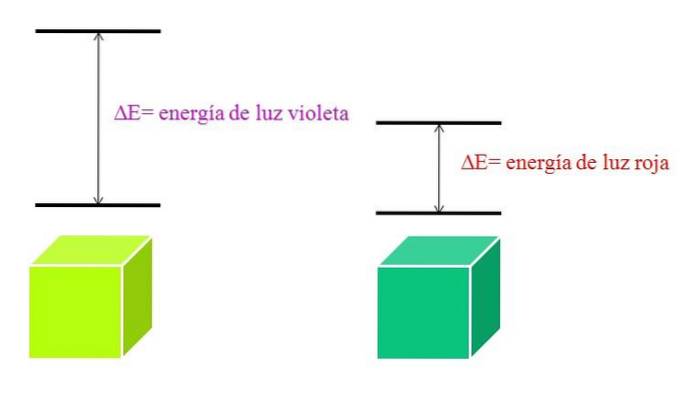
Au fur et à mesure que λ augmente, la fréquence du photon diminue, et donc son énergie. Ainsi, la lumière violette a une énergie plus élevée (longueurs d'onde plus courtes) que la lumière rouge (longueurs d'onde plus longues). Par conséquent, un matériau qui absorbe la lumière violette implique des transitions électroniques d'énergies plus élevées..
Et si le matériau absorbe la couleur violette, quelle couleur reflétera-t-il? Il apparaîtra d'une couleur jaune verdâtre, ce qui signifie que ses électrons effectuent des transitions très énergétiques; tandis que si le matériau absorbe la couleur rouge à faible énergie, il reflétera une couleur vert bleuâtre.
Lorsqu'un atome est très stable, il présente généralement des états électroniques d'énergie très éloignés; et par conséquent, vous devrez absorber des photons d'énergie plus élevée pour permettre les transitions électroniques:
Spectre d'absorption des molécules
Les molécules ont des atomes, et ceux-ci absorbent également le rayonnement électromagnétique; cependant, leurs électrons font partie de la liaison chimique, de sorte que leurs transitions sont différentes. L'un des grands triomphes de la théorie des orbitales moléculaires est le pouvoir de relier les spectres d'absorption à la structure chimique.
Ainsi, les liaisons simples, doubles, triples, conjuguées et les structures aromatiques ont leurs propres états électroniques; et donc absorber des photons très spécifiques.
En ayant plusieurs atomes, en plus des interactions intermoléculaires, et des vibrations de leurs liaisons (qui absorbent également de l'énergie), les spectres d'absorption des molécules ont la forme de «montagnes», qui indiquent les bandes qui composent les longueurs d'onde où se produisent les transitions électroniques.
Grâce à ces spectres, un composé peut être caractérisé, identifié et même, par analyse multivariée, quantifié.
Bleu de méthylène
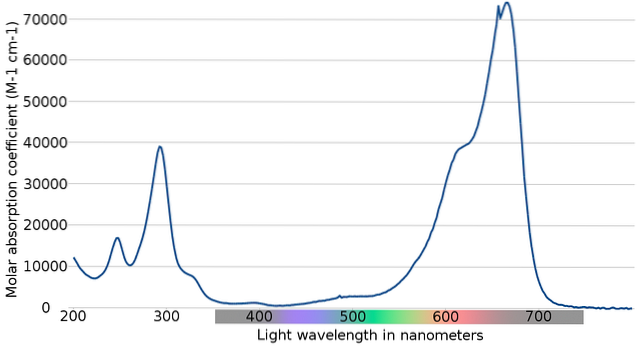
L'image du haut montre le spectre de l'indicateur bleu de méthylène. Comme son nom l'indique, il est de couleur bleue; mais, peut-il être vérifié avec son spectre d'absorption?
Notez qu'il existe des bandes entre les longueurs d'onde de 200 et 300 nm. Entre 400 et 500 nm, il n'y a presque pas d'absorption, c'est-à-dire qu'il n'absorbe pas les couleurs violettes, bleues ou vertes.
Cependant, il a une bande d'absorption forte après 600 nm, et a donc des transitions électroniques à faible énergie qui absorbent les photons de la lumière rouge..
Par conséquent, et compte tenu des valeurs élevées des absorptivités molaires, le bleu de méthylène présente une couleur bleu intense..
Chlorophylles a et b
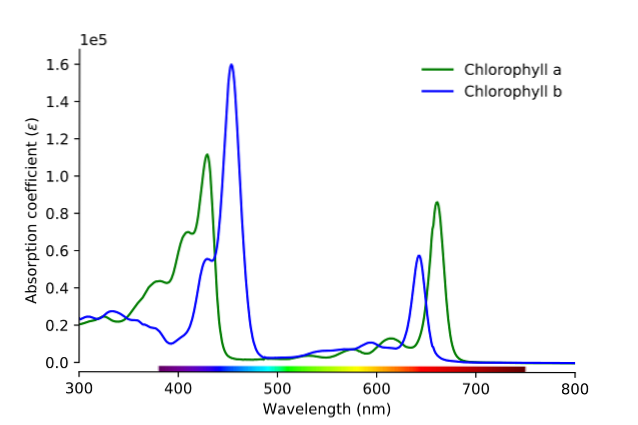
Comme on peut le voir sur l'image, la ligne verte correspond au spectre d'absorption de la chlorophylle a, tandis que la ligne bleue correspond à celle de la chlorophylle b.
Premièrement, les bandes où les absorptivités molaires sont les plus élevées doivent être comparées; dans ce cas, ceux de gauche, entre 400 et 500 nm. La chlorophylle a absorbe fortement les couleurs violettes, tandis que la chlorophylle b (ligne bleue) absorbe les couleurs bleues.
En absorbant la chlorophylle b vers 460 nm, le bleu, la couleur jaune se reflète. D'autre part, il absorbe également fortement près de 650 nm, la lumière orange, ce qui signifie qu'il présente la couleur bleue. Si le jaune et le bleu se mélangent, quel est le résultat? La couleur verte.
Et enfin, la chlorophylle a absorbe la couleur bleu-violet, ainsi qu'une lumière rouge proche de 660 nm. Par conséquent, il présente une couleur verte «adoucie» par le jaune..
Les références
- Observatoire de Paris. (s.f.). Les différentes classes de spectres. Récupéré de: media4.obspm.fr
- Campus universitaire de Rabanales. (s.f.). Spectrophotométrie: spectres d'absorption et quantification colorimétrique des biomolécules. [PDF]. Récupéré de: uco.es
- Day, R. et Underwood, A. (1986). Chimie analytique quantitative (cinquième éd.). PEARSON, Prentice Hall, p 461-464.
- Reush W. (s.f.). Spectroscopie visible et ultraviolette. Récupéré de: 2.chemistry.msu.edu
- David Darling. (2016). Spectre d'absorption. Récupéré de: daviddarling.info
- Khan Academy. (2018). Lignes d'absorption / émission. Récupéré de: khanacademy.org



Personne n'a encore commenté ce post.