
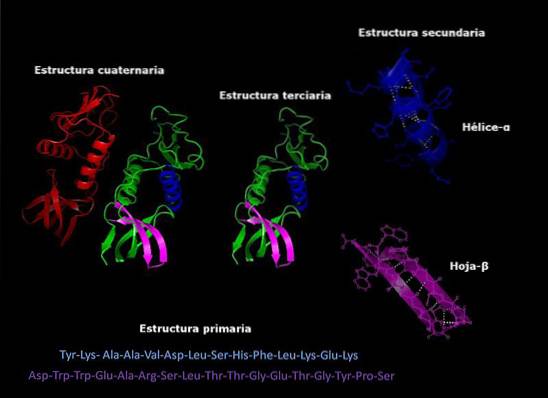
Structure primaire des protéines caractéristiques
La structure primaire de protéines C'est l'ordre dans lequel sont disposés les acides aminés du polypeptide ou des polypeptides qui les comprennent. Une protéine est un biopolymère composé de monomères d'acide α-aminé liés par des liaisons peptidiques. Chaque protéine a une séquence définie de ces acides aminés.
Les protéines remplissent une grande variété de fonctions biologiques, y compris la mise en forme et le maintien de l'intégrité des cellules à travers le cytosquelette, la défense du corps contre les agents étrangers par le biais d'anticorps et la catalyse de réactions chimiques dans le corps par des enzymes..
Aujourd'hui, la détermination de la composition des protéines et de l'ordre dans lequel les acides aminés sont disposés (séquençage) est plus rapide qu'il y a des années. Ces informations sont déposées dans des bases de données électroniques internationales, accessibles via Internet (GenBank, PIR, entre autres).
Index des articles
- 1 Acides aminés
- 1.1 Acides aminés aliphatiques
- 1.2 Acides aminés avec des chaînes latérales contenant de l'hydroxyle ou du soufre
- 1.3 Acides aminés cycliques
- 1.4 Acides aminés aromatiques
- 1.5 Acides aminés basiques
- 1.6 Acides aminés acides et leurs amides
- 2 liaisons peptidiques
- 3 Séquence d'acides aminés
- 4 Codage des protéines
- 5 Références
Acides aminés
Les acides aminés sont des molécules qui contiennent un groupe amino et un groupe acide carboxylique. Dans le cas des acides α-aminés, ils ont un atome de carbone central (carbone α) auquel le groupe amino et le groupe carboxyle sont attachés, ainsi qu'un atome d'hydrogène et un groupe R distinctif, appelé chaîne latérale.
En raison de cette configuration du carbone α, les acides aminés formés, appelés acides α-aminés, sont chiraux. Deux formes sont produites qui sont des images miroir l'une de l'autre et sont appelées énantiomères L et D..
Toutes les protéines des êtres vivants sont constituées de 20 α-acides aminés de la configuration L. Les chaînes latérales de ces 20 acides aminés sont différentes et ont une grande diversité de groupes chimiques.
Fondamentalement, les acides α-aminés peuvent être groupés (arbitrairement) en fonction du type de chaîne latérale comme suit.
Acides aminés aliphatiques
Dans ce groupe sont contenues, selon certains auteurs, la glycine (Gli), l'alanine (Ala), la valine (Val), la leucine (Leu) et l'isoleucine (Ile). D'autres auteurs incluent également Methionine (Met) et Proline (Pro).
Acides aminés à chaînes latérales hydroxylées ou soufrées
Contient de la sérine (Ser), de la cystéine (Cys), de la thréonine (Thr) et également de la méthionine. Selon certains auteurs, le groupe ne devrait inclure que Ser et Thr.
Acides aminés cycliques
Composé uniquement de Proline, qui, comme déjà noté, est inclus par d'autres auteurs parmi les acides aminés aliphatiques.
Acides aminés aromatiques
Phénylalanine (Phe), Tyrosine (Tyr) et Tryptophane (Trp).
Acides aminés basiques
Histidine (His), Lysine (Lys) et Arginine (Arg)
Acides aminés acides et leurs amides
Il contient des acides aspartique (Asp) et glutamique (Glu) ainsi que les amides Aspargine (Asn) et Glutamine (Gln). Certains auteurs séparent ce dernier groupe en deux; d'une part celle des acides aminés acides (les deux premiers), et d'autre part ceux qui contiennent du carboxylamide (les deux autres).
Liaisons peptidiques
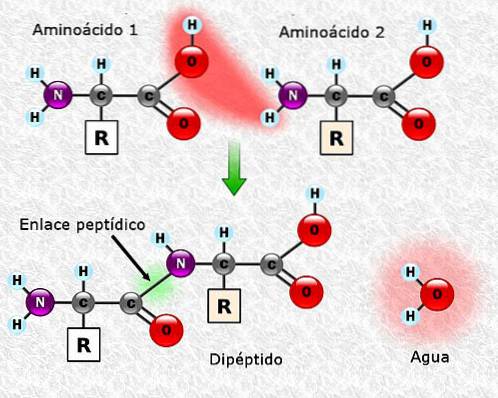
Les acides aminés peuvent être liés entre eux au moyen de liaisons peptidiques. Ces liaisons, également appelées liaisons amide, sont établies entre le groupe α-amino d'un acide aminé et le groupe α-carboxyle d'un autre. Cette union se forme avec la perte d'une molécule d'eau.
L'union entre deux acides aminés entraîne la formation d'un dipeptide, et si de nouveaux acides aminés sont ajoutés, des tripeptides, des tétrapeptides, etc. pourraient se former séquentiellement..
Les polypeptides constitués d'un petit nombre d'acides aminés sont généralement appelés oligopeptides, et si le nombre d'acides aminés est élevé, ils sont appelés polypeptides..
Chaque acide aminé ajouté à la chaîne polypeptidique libère une molécule d'eau. La partie de l'acide aminé qui a perdu le H + ou OH- au cours de l'union est appelée le résidu d'acide aminé.
La plupart de ces chaînes oligopeptidiques et polypeptidiques auront, à une extrémité, un groupe amino-terminal (N-terminal), et à l'autre un carboxyle terminal (C-terminal). De plus, ils peuvent contenir de nombreux groupes ionisables entre les chaînes latérales des résidus d'acides aminés qui les composent. Pour cette raison, ils sont considérés comme des polyampolithes.
Séquence d'acides aminés
Chaque protéine a une certaine séquence de ses résidus d'acides aminés. Cet ordre est ce que l'on appelle la structure primaire de la protéine..
Chaque protéine individuelle dans chaque organisme est spécifique à l'espèce. Autrement dit, la myoglobine d'un être humain est identique à celle d'un autre être humain, mais elle présente de petites différences avec les myoglobines d'autres mammifères..
La quantité et les types d'acides aminés qu'une protéine contient sont aussi importants que l'emplacement de ces acides aminés dans la chaîne polypeptidique. Pour comprendre les protéines, les biochimistes doivent d'abord isoler et purifier chaque protéine particulière, puis faire une analyse de la teneur en acides aminés et enfin déterminer sa séquence..
Pour isoler et purifier les protéines, il existe différentes méthodes, parmi lesquelles: la centrifugation, la chromatographie, la filtration sur gel, la dialyse et l'ultrafiltration, ainsi que l'utilisation des propriétés de solubilité de la protéine à l'étude..
La détermination des acides aminés présents dans les protéines se fait en trois étapes. La première consiste à rompre les liaisons peptidiques par hydrolyse. Par la suite, les différents types d'acides aminés dans le mélange sont séparés; et enfin, chacun des types d'acides aminés obtenus est quantifié.
Pour déterminer la structure primaire de la protéine, différentes méthodes peuvent être utilisées; mais actuellement la méthode la plus largement utilisée est la méthode Edman, qui consiste essentiellement à marquer et à séparer l'acide aminé N-terminal du reste de la chaîne à plusieurs reprises, et à identifier chaque acide aminé libéré individuellement.
Codage des protéines
La structure primaire des protéines est codée dans les gènes des organismes. Les informations génétiques sont contenues dans l'ADN, mais pour sa traduction en protéines, elles doivent d'abord être transcrites en molécules d'ARNm. Chaque triplet de nucléotides (codon) code pour un acide aminé.
Puisqu'il y a 64 codons possibles et que seulement 20 acides aminés sont utilisés dans la construction des protéines, chaque acide aminé peut être codé par plus d'un codon. Pratiquement tous les êtres vivants utilisent les mêmes codons pour coder les mêmes acides aminés. Par conséquent, le code génétique est considéré comme un langage presque universel.
Dans ce code, il y a des codons utilisés pour démarrer et également arrêter la traduction du polypeptide. Les codons stop ne codent pour aucun acide aminé, mais arrêtent la traduction à l'extrémité C-terminale de la chaîne, et sont représentés par les triplets UAA, UAG et UGA..
D'autre part, le codon AUG fonctionne normalement comme un signal de départ et code également pour la méthionine..
Après la traduction, les protéines peuvent subir un certain traitement ou une modification, comme un raccourcissement par fragmentation, pour atteindre leur configuration finale.
Les références
- C.K. Mathews, K.E. van Holde et K.G. Ahern. 2002. Biochimie. 3e édition. Benjamin / Cummings Publishing Company, Inc.
- Murray, P. Mayes, D.C. Granner et V.W. Rodwell. 1996. La biochimie de Harper. Appleton et Lange
- J.M. Berg, J.L. Tymoczko et L. Stryer (sd). Biochimie. 5e édition. W. H. Freeman et compagnie.
- J. Koolman et K.-H. Roehm (2005). Atlas des couleurs de la biochimie. deuxnd édition. Thieme.
- A. Lehninger (1978). Biochimie. Ediciones Omega, S.A.
- L. Stryer (1995). Biochimie. W.H. Freeman and Company, New York.



Personne n'a encore commenté ce post.