
Propriétés, risques et utilisations du ferrocyanure de potassium
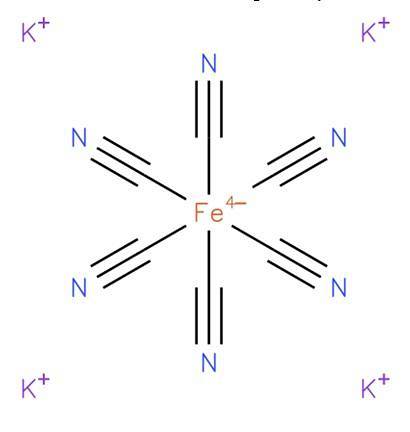
le ferrocyanure de potassium, également connu sous le nom d'hexacyanoferrate de potassium (II) ou jaune de Prusse, c'est un composé inorganique de formule K4[Faith (CN)6]. C'est un sel de potassium du complexe de coordination du ferrocyanure (Fe (CN)64-) et se présente généralement sous la forme trihydratée K4[Faith (CN)6] · HdeuxO. Sa structure est illustrée à la figure 1 (EMBL-EBI, 2008).
Historiquement, il était fabriqué à partir de sources de dioxyde de carbone d'origine biologique, de limaille de fer et de carbonate de potassium. Les sources courantes d'azote et de carbone étaient les chutes de cuir, les abats ou le sang séché.
Actuellement, le ferrocyanure de potassium est produit industriellement à partir de cyanure d'hydrogène, de chlorure ferreux et d'hydroxyde de calcium, dont la combinaison donne du Cadeux [Faith (CN) 6] · 11HdeuxOU ALORS.
Cette solution est ensuite traitée avec des sels de potassium pour précipiter le sel mixte calcium-potassium CaK.deux [Faith (CN) 6], qui à son tour est traité avec du carbonate de potassium pour donner le sel tétrapotassique.
Index des articles
- 1 Propriétés physiques et chimiques
- 2 Réactivité et dangers
- 2.1 Contact avec les yeux
- 2.2 Contact cutané
- 2.3 Inhalation
- 2.4 Ingestion
- 3 utilisations
- 3.1 1- Industrie alimentaire
- 3.2 2- Industrie minière et métallurgique
- 3.3 3- Réactif de laboratoire
- 4 Références
Proprietes physiques et chimiques
Le ferrocyanure de potassium est un cristal monoclinique de couleur jaune ou jaune pâle, selon le niveau d'hydratation, sans arôme caractéristique (National Center for Biotechnology Information., 2017). Son aspect est illustré à la figure 2 (Potassium ferrocyanide, 2017).

Le composé a un poids moléculaire de 368,35 g / mol pour la forme anhydre et de 422,388 g / mol pour la forme trihydrate. Il a une densité de 1,85 g / ml et un point de fusion de 70 ° C où il commence à se décomposer (Royal Society of Chemistry, 2015).
Le composé est soluble dans l'eau, pouvant dissoudre 28,9 grammes de composé dans 100 ml de ce solvant. Il est insoluble dans l'éther diéthylique, l'éthanol et le toluène. Le composé réagit à la chaleur pour former du cyanure de potassium selon la réaction:
K4[Faith (CN)6] → 4 KCN + FeCdeux + Ndeux
En combinaison avec des acides concentrés, il forme du cyanure d'hydrogène (HCN) qui est un gaz hautement toxique et inflammable et peut former des mélanges explosifs dans l'air (Laffort, 2001).
Réactivité et dangers
Le ferrocyanure de potassium est un composé stable, incompatible avec les acides forts et les agents oxydants. Le ferrocyanure de potassium est non toxique et ne se décompose pas en cyanure dans le corps. La toxicité chez le rat est faible, avec une dose létale (DL50) de 6400 mg / kg.
La substance est toxique pour les poumons et les muqueuses. Le composé peut provoquer une irritation en cas de contact avec la peau et les yeux..
Lorsqu'il est ingéré, il peut provoquer une irritation du tractus gastro-intestinal et en cas d'inhalation, il provoque une irritation de la muqueuse nasale et du système respiratoire..
Le contact avec les yeux peut entraîner des lésions cornéennes ou la cécité. Le contact avec la peau peut provoquer une inflammation et des cloques.
L'inhalation de poussière provoquera une irritation des voies gastro-intestinales ou respiratoires, caractérisée par des brûlures, des éternuements et de la toux. Une surexposition sévère peut provoquer des lésions pulmonaires, une suffocation, une perte de conscience ou la mort..
Lentilles de contact
En cas de contact avec les yeux, les lentilles de contact doivent être vérifiées et retirées. Les yeux doivent être rincés immédiatement à grande eau froide pendant au moins 15 minutes.
Contact avec la peau
La zone touchée doit être rincée immédiatement à grande eau pendant au moins 15 minutes tout en retirant les vêtements et les chaussures contaminés. Couvrir la peau irritée d'un émollient.
Lavez les vêtements et les chaussures avant de les réutiliser. Si le contact est sévère, laver avec un savon désinfectant et recouvrir la peau contaminée d'une crème antibactérienne.
Inhalation
La victime doit être déplacée dans un endroit frais. S'il ne respire pas, la respiration artificielle doit être pratiquée. Si la respiration est difficile, donnez de l'oxygène.
Ingestion
Si le composé est ingéré, le vomissement ne doit pas être provoqué sauf indication contraire par le personnel médical. Desserrez les vêtements serrés comme un col de chemise, une ceinture ou une cravate.
Dans tous les cas, une attention médicale doit être obtenue immédiatement (Fiche signalétique Ferrocyanure de potassium trihydraté, 2013).
Applications
1- Industrie alimentaire
Le jaune de Prusse est également connu pour son numéro d'additif alimentaire européen approuvé: E536 et a diverses utilisations dans l'industrie alimentaire. Il est utilisé comme agent anti-agglomérant pour le sel de voirie et le sel de table.
Il a également une utilité œnologique pour éliminer le cuivre et le fer en vinification. Le cuivre est utilisé comme fongicide dans le raisin (Université de Wageningen, 2014).
Il est également utilisé pour la fermentation de l'acide citrique (D. S. Clark, 1965). Le ferrocyanure de potassium peut également être utilisé comme engrais pour les plantes.
2- Industrie minière et métallurgique
Le ferrocyanure de potassium est utilisé pour éliminer le cuivre des minéraux de molybdène. Il est également utilisé pour la cimentation de l'acier (Ferrocyanure de potassium, K4Fe (CN) 6, 2012).
La cémentation est un traitement thermochimique appliqué aux pièces en acier. Le procédé amène le carbone à la surface par diffusion, qui s'imprègne en modifiant sa composition.
3- Réactif de laboratoire
Le ferrocyanure de potassium est utilisé pour déterminer la concentration de permanganate de potassium, un composé souvent utilisé dans les titrages basés sur des réactions redox..
Le ferrocyanure de potassium est utilisé en mélange avec du ferricyanure de potassium et une solution tamponnée au phosphate pour fournir un tampon pour la bêta-galactosidase, qui est utilisé pour cliver X-Gal (5-bromo-4-chloro-3-indolyl-β -D-galactopyranoside, donnant une visualisation bleu vif où un anticorps (ou une autre molécule), conjugué à Beta-gal, s'est lié à sa cible.
Le composé est également utilisé pour la production de bleu de Prusse. Lorsqu'il réagit avec Fe (III), il donne une couleur bleu de Prusse, c'est pourquoi il est utilisé comme réactif d'identification du fer dans les laboratoires..
Il est également utilisé pour la détermination du zinc dans les échantillons de sulfure de zinc. L'échantillon est dissous dans HCl 6N et faire bouillir sous une hotte pour éliminer le sulfure d'hydrogène, neutraliser avec de l'hydroxyde d'ammonium et ajouter 3 gouttes de HCl.
Porter à ébullition et ajouter 5 ml de solution 1N de ferrocyanure de potassium. La présence d'un précipité de ferrocyanure de zinc blanc indique un test positif pour cet élément (Mehlig, 1927).
Les références
- S. Clark, K. I. (1965). Effet du ferrocyanure de potassium sur la composition chimique de la purée de mélasse utilisée dans la fermentation de l'acide citrique. Biotechnologie et bio-ingénierie Volume 7, Numéro 2, 269-278. Récupéré de onlinelibrary.wiley.com.
- EMBL-EBI. (2008, 16 janvier). hexacyanoferrate de potassium (4−). Récupéré de ebi.ac.uk.
- (2001, 5 mars). FERROCYANURE DE POTASSIUM. Récupéré de laffort.com.
- Fiche signalétique Ferrocyanure de potassium trihydraté. (2013, 21 mai). Récupéré de sciencelab.com.
- Mehlig, J. P. (1927). Utilisation du ferrocyanure de potassium comme test de confirmation du zinc. Chem. Educ.4 (6), 722. Récupéré de pubs.acs.org.
- Centre national d'information sur la biotechnologie… (15 avril 2017). Base de données des composés PubChem; CID = 161067. Récupéré de pubchem.ncbi.nlm.nih.gov.
- Ferrocyanure de potassium. (2017, 25 mars). Récupéré de sciencemadness.org.
- Ferrocyanure de potassium, K4Fe (CN) 6. (2012). Récupéré de atomistry.com.
- Société royale de chimie. (2015). ferrocyanure de potassium. Récupéré de chemspider.com.
- Université de Wageningen. (2014, 14 août). E536: ferrocyanure de potassium. Récupéré de food-info.net.


Personne n'a encore commenté ce post.