
Structure, propriétés, synthèse, utilisations du fluorure de magnésium
le fluorure de magnésium c'est un sel inorganique incolore dont la formule chimique est MgF₂. Il se trouve dans la nature sous forme de sellaite minérale. Il a un point de fusion très élevé et est très peu soluble dans l'eau. Il est relativement inerte car, par exemple, sa réaction avec l'acide sulfurique est lente et incomplète et il résiste à l'hydrolyse avec l'acide fluorhydrique (HF) jusqu'à 750 ° C..
C'est un composé peu affecté par les rayonnements à haute énergie. De plus, il possède un faible indice de réfraction, une résistance élevée à la corrosion, une bonne stabilité thermique, une dureté importante et d'excellentes propriétés de transmission de la lumière visible, UV (ultraviolette) et IR (infrarouge)..
Ces propriétés lui confèrent d'excellentes performances dans le domaine optique et en font en outre un matériau utile comme support de catalyseur, élément de revêtement, lentilles antireflet et fenêtres pour transmission infrarouge, entre autres applications..
Index des articles
- 1 Structure
- 2 propriétés
- 3 Synthèse et préparation
- 4 utilisations
- 4.1 Optique
- 4.2 Catalyse ou accélération des réactions
- 4.3 Autres utilisations
- 5 Références
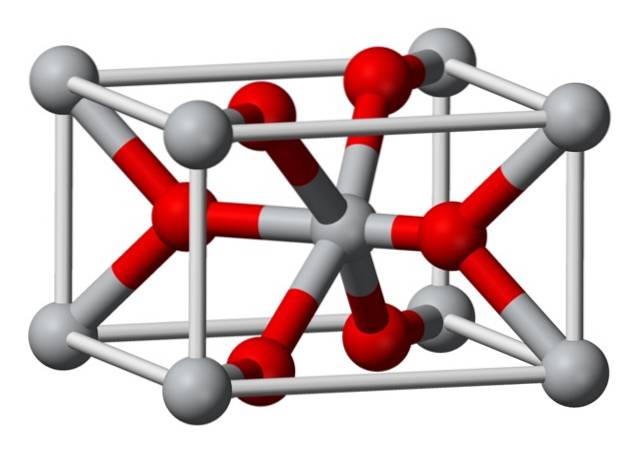
Structure
La structure cristalline du fluorure de magnésium préparé chimiquement est du même type que celle de la sellaite minérale naturelle. Cristallise dans la classe dipyramidale du système tétragonal.
Les ions magnésium (Mg2 +) sont situés dans un espace de réseau tétragonal centré, tandis que les ions fluorure (F-) se trouvent dans le même plan que et associés à leurs voisins Mg2 +, groupés par paires les uns avec les autres. La distance entre les ions Mg2 + et F- est de 2,07 Å (angströms) (2,07 × 10-10 m).
Sa coordination cristalline est 6: 3. Cela signifie que chaque ion Mg2 + est entouré de 6 ions F- et chaque ion F-, à son tour, est entouré de 3 ions Mg2 + 5..
La structure est très similaire à celle du rutile minéral, qui est la forme naturelle du dioxyde de titane (TiO2), avec laquelle il a plusieurs propriétés cristallographiques en commun..
Lors de sa production, le fluorure de magnésium ne précipite pas sous forme de solide amorphe, car les ions Mg2 + et F- n'ont pas tendance à former des complexes polymériques en solution..
Propriétés
Fait intéressant, le fluorure de magnésium est un matériau biréfringent. Il s'agit d'une propriété optique qui permet à un rayon lumineux incident d'être divisé en deux rayons distincts qui se propagent à des vitesses et des longueurs d'onde différentes..
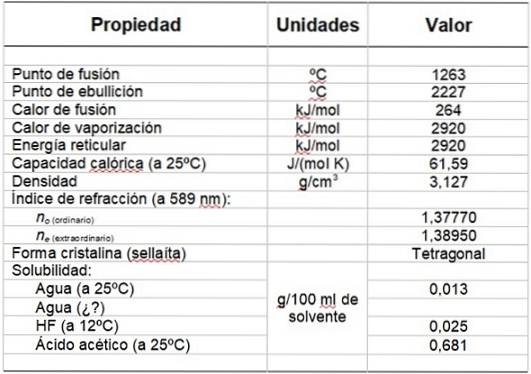
Le tableau 1 montre certaines de ses propriétés.
Tableau 1. Propriétés physiques et chimiques du fluorure de magnésium.
Synthèse et préparation
Il peut être préparé de différentes manières, notamment les suivantes:
1-Par la réaction entre l'oxyde de magnésium (MgO) ou le carbonate de magnésium (MgCO3) avec l'acide fluorhydrique (HF) 2:
MgO + 2 HF MgF2 + H2O
MgCO3 + 2 HF MgF2 + CO2 + H2O
2-Par réaction entre le carbonate de magnésium et le bifluorure d'ammonium (NH4HF2), tous deux à l'état solide, à une température comprise entre 150 et 400ºC2:
150 à 400 ° C
MgCO3 + NH4HF2 MgF2 + NH3 + CO2 + H2O
3-Chauffage d'une solution aqueuse de carbonate de magnésium et de fluorure d'ammonium (NH4F) en présence d'hydroxyde d'ammonium (NH4OH) à 60 ° C 2:
60 ° C, NH4OH
MgCO3 + 3 NH4F NH4MgF3 + (NH4) 2CO3
Le précipité résultant de fluorure de magnésium ammonium (NH4MgF3) est ensuite chauffé à 620 ° C pendant 4 heures pour obtenir du fluorure de magnésium:
620 ° C
NH4MgF3 MgF2 + NH3 + HF
4-En tant que sous-produit de l'obtention du béryllium (Be) et de l'uranium (U). Le fluorure de l'élément souhaité est chauffé avec du magnésium métallique dans un creuset revêtu de MgF2 2:
BeF2 + Mg Be + MgF2
5-Réaction du chlorure de magnésium (MgCl2) avec le fluorure d'ammonium (NH4F) en solution aqueuse à température ambiante 3:
25 ° C, H2O
MgCl2 + 2 NH4F MgF2 + 2NH4Cl
Les méthodes de préparation du MgF2 étant coûteuses, il existe des tentatives pour l'obtenir de manière plus économique, parmi lesquelles la méthode de production à partir de l'eau de mer se distingue..
Ceci se caractérise par l'ajout d'une quantité suffisante d'ions fluorure (F-) à l'eau de mer, qui a une concentration abondante d'ions magnésium (Mg2 +), favorisant ainsi la précipitation du MgF2..
Les cristaux optiques de fluorure de magnésium sont obtenus par pressage à chaud de poudre de MgF2 de haute qualité, obtenue par exemple par la méthode NH4HF2.
Il existe de nombreuses techniques pour préparer des matériaux au fluorure de magnésium, telles que la croissance monocristalline, le frittage (compactage pour mouler ou mise en forme) sans pression, pressage à chaud et frittage par micro-ondes..
Applications
Optique
Les cristaux de MgF2 conviennent aux applications optiques car ils sont transparents de la région UV à la région IR moyenne 2.10.
En tant que film inerte, il est utilisé pour modifier les propriétés de transmission de la lumière des matériaux optiques et électroniques. L'une des principales applications est l'optique VUV pour la technologie d'exploration spatiale.
En raison de sa propriété de biréfringence, ce matériau est utile dans l'optique de polarisation, dans les fenêtres et les prismes du laser Excimer (un type de laser ultraviolet utilisé en chirurgie oculaire)..
Il est à noter que le fluorure de magnésium utilisé dans la fabrication de matériaux optiques en couches minces doit être exempt d'impuretés ou de composés sources d'oxyde, tels que l'eau (H2O), les ions hydroxyde (OH-), les ions carbonate (CO3 = ), ions sulfate (SO4 =), etc. 12.
Catalyse ou accélération des réactions
Le MgF2 a été utilisé avec succès comme support de catalyseur pour la réaction d'élimination du chlore et d'addition d'hydrogène dans les CFC (chlorofluorocarbures), les réfrigérants connus et les propulseurs d'aérosol, et responsable des dommages causés à la couche d'ozone de l'atmosphère..
Les composés qui en résultent, HFC (hydrofluorocarbures) et HCFC (hydrochlorofluorocarbures), ne présentent pas cet effet nocif pour l'atmosphère 5.
Il a également été utile comme support de catalyseur pour l'hydrodésulfuration (élimination du soufre) de composés organiques..
Autres utilisations
Les matériaux générés par l'intercalation du graphite, du fluor et du MgF2 présentent une conductivité électrique élevée, c'est pourquoi ils ont été proposés pour une utilisation dans des cathodes et comme matériaux électroconducteurs..
L'eutectique formé par NaF et MgF2 a des propriétés de stockage d'énergie sous forme de chaleur latente, c'est pourquoi il a été envisagé pour une utilisation dans les systèmes d'énergie solaire..
Dans le domaine de la biochimie, le fluorure de magnésium, avec d'autres fluorures métalliques, est utilisé pour inhiber les réactions de transfert de phosphoryle dans les enzymes.
Récemment, des nanoparticules de MgF2 ont été testées avec succès en tant que vecteurs d'administration de médicaments dans des cellules malades pour le traitement du cancer..
Les références
- Buckley, S.E. et Vernon, W.S. (1925) XCIV. La structure cristalline du fluorure de magnésium. Magazine philosophique Série 6, 49: 293, 945-951.
- Kirk-Othmer (1994). Encyclopédie de la technologie chimique, volume 11, cinquième édition, John Wiley & Sons. ISBN 0-471-52680-0 (v.11).
- Peng, Minhong; Cao, Weiping; et Song, Jinhong. (2015). Préparation de la céramique translucide MgF2 par frittage à chaud. Journal de l'Université de technologie de Wuhan-Mater: Sci. Ed. Vol. 30 n ° 4.
- Непоклонов, И.С. (2011). Fluorure de magnésium. Source: Travail personnel.
- Wojciechowska, Maria; Zielinski, Michal; et Pietrowski, Mariusz. (2003). MgF2 comme support de catalyseur non conventionnel. Journal of Fluorine Chemistry, 120 (2003) 1-11.
- Korth Kristalle GmbH. (2019). Fluorure de magnésium (MgF2). Récupéré le 12/07/2019 sur: korth.de
- Sevonkaev, Igor et Matijevic, Egon. (2009). Formation de particules de fluorure de magnésium de différentes morphologies. Langmuir 2009, 25 (18), 10534-10539.
- Непоклонов, И.С. (2013). Fluorure de magnésium. Source: Travail personnel.
- Tao Qin, Peng Zhang et Weiwei Qin. (2017). Une nouvelle méthode pour synthétiser des sphères de fluorure de magnésium bon marché à partir d'eau de mer. Ceramics International 43 (2017) 14481-14483.
- Encyclopédie Ullmann de chimie industrielle (1996) Cinquième édition. Volume A11. VCH Verlagsgesellschaft mbH. New York. ISBN 0-89573-161-4.
- NASA (2013). Ingénieurs inspectant le miroir primaire du télescope spatial Hubble 8109563. Source: mix.msfc.nasa.gov



Personne n'a encore commenté ce post.