
Structure, propriétés et utilisations du phosphate de calcium (Ca3 (PO4) 2)

le le phosphate de calcium est un sel inorganique et tertiaire dont la formule chimique est Ca3(PO4)deux. La formule indique que la composition de ce sel est de 3: 2 pour le calcium et le phosphate, respectivement. Cela peut être vu directement dans l'image ci-dessous, où le cation Ca est montré.deux+ et l'anion PO43-. Pour chaque trois Cadeux+ il y a deux PO43- interagir avec eux.
D'autre part, le phosphate de calcium fait référence à une série de sels qui varient en fonction du rapport Ca / P, ainsi que du degré d'hydratation et du pH. En fait, il existe de nombreux types de phosphates de calcium qui existent et peuvent être synthétisés. Cependant, suivant la nomenclature à la lettre, le phosphate de calcium se réfère uniquement au tricalcium, le.

Tous les phosphates de calcium, y compris Ca3(PO4)deux, ils sont d'un blanc uni avec de légères teintes grisâtres. Ils peuvent être granuleux, fins, cristallins et avoir des tailles de particules d'environ microns; et même des nanoparticules de ces phosphates ont été préparées, avec lesquelles des matériaux biocompatibles pour les os sont conçus.
Cette biocompatibilité est due au fait que ces sels se retrouvent dans les dents et, en somme, dans les tissus osseux des mammifères. Par exemple, l'hydroxyapatite est un phosphate de calcium cristallin, qui à son tour interagit avec une phase amorphe du même sel..
Cela signifie qu'il existe des phosphates de calcium amorphes et cristallins. Pour cette raison, il n'est pas surprenant de la diversité et des multiples options lors de la synthèse de matériaux à base de phosphates de calcium; des matériaux dont les propriétés sont chaque jour plus nombreuses dans le monde à s'intéresser à la restauration des os.
Index des articles
- 1 Structure du phosphate de calcium
- 1.1 Phosphate de calcium amorphe
- 1.2 Le reste de la famille
- 2 Propriétés physiques et chimiques
- 2.1 Noms
- 2.2 Poids moléculaire
- 2.3 Description physique
- 2.4 Saveur
- 2.5 Point de fusion
- 2.6 Solubilité
- 2.7 Densité
- 2.8 Indice de réfraction
- 2.9 Enthalpie de formation standard
- 2.10 Température de stockage
- 2.11 pH
- 3 Formation
- 3.1 Nitrate de calcium et hydrogénophosphate d'ammonium
- 3.2 Hydroxyde de calcium et acide phosphorique
- 4 utilisations
- 4.1 Dans le tissu osseux
- 4.2 Ciments biocéramiques
- 4.3 Médecins
- 4.4 Autres
- 5 Références
Structure du phosphate de calcium
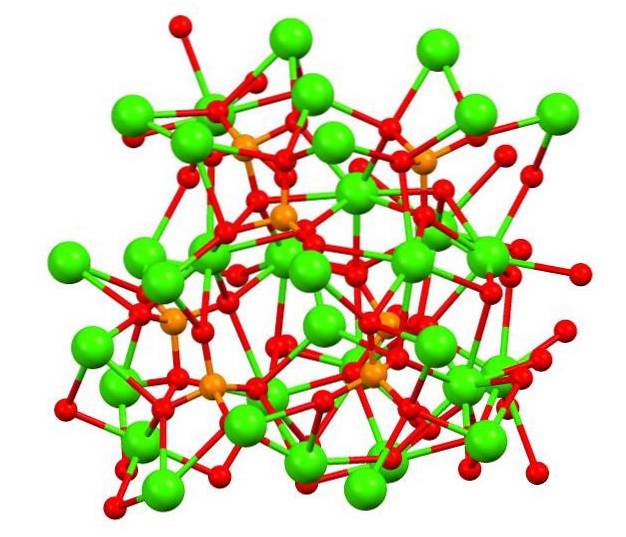
L'image du haut montre la structure du phosphate de calicot tribasique dans l'étrange minéral whitlockite, qui peut contenir du magnésium et du fer comme impuretés..
Bien qu'à première vue cela puisse paraître complexe, il est nécessaire de préciser que le modèle suppose des interactions covalentes entre les atomes d'oxygène des phosphates et les centres métalliques du calcium..
A titre de représentation c'est valable, cependant, les interactions sont électrostatiques; c'est-à-dire que les cations Cadeux+ sont attirés par les anions PO43- (ACdeux+- O-PO33-). Dans cet esprit, on comprend pourquoi dans l'image le calcium (sphères vertes) est entouré par les atomes d'oxygène chargés négativement (sphères rouges).
Parce qu'il y a tellement d'ions, cela ne laisse pas un arrangement ou un motif symétrique visible. La CA3(PO4)deux adopte à basse température (T<1000°C) una celda unitaria correspondiente a un sistema cristalino romboédrico; a este polimorfo se le conoce con el nombre de β-Ca3(PO4)deux (β-TCP).
À haute température, en revanche, il se transforme en polymorphe α-Ca3(PO4)deux (α-TCP), dont la maille unitaire correspond à un système cristallin monoclinique. A des températures encore plus élevées, le polymorphe α'-Ca peut également se former.3(PO4)deux, qui est de structure cristalline hexagonale.
Phosphate de calcium amorphe
Des structures cristallines ont été mentionnées pour le phosphate de calcium, ce que l'on attend d'un sel. Cependant, il est capable de présenter des structures désordonnées et asymétriques, liées plus à un type de «verre de phosphate de calcium» qu'à des cristaux au sens strict de sa définition..
Lorsque cela se produit, on dit que le phosphate de calcium a une structure amorphe (ACP, phosphate de calcium amorphe). Plusieurs auteurs pointent ce type de structure comme responsable des propriétés biologiques du Ca3(PO4)deux dans les tissus osseux, sa réparation et sa biomimétisation étant possibles.
En élucidant sa structure par résonance magnétique nucléaire (RMN), la présence d'ions OH a été trouvée- et HPO4deux- dans les ACP. Ces ions sont formés par l'hydrolyse de l'un des phosphates:
PO43- + HdeuxOU ALORS <=> HPO4deux- + Oh-
En conséquence, la véritable structure de l'ACP devient plus complexe, dont la composition de ses ions est représentée par la formule: Ca9(PO4)6 x(HPO4)X(OH)X. Le 'x' indique le degré d'hydratation, car si x = 1, alors la formule serait la suivante: Ca9(PO4)5(HPO4) (OH).
Les différentes structures que l'ACP peut avoir dépendent des rapports molaires Ca / P; c'est-à-dire des quantités relatives de calcium et de phosphate, qui modifient toute leur composition résultante.
Le reste de la famille
Les phosphates de calcium sont en fait une famille de composés inorganiques, qui à leur tour peuvent interagir avec une matrice organique.
Les autres phosphates sont obtenus "simplement" en changeant les anions qui accompagnent le calcium (PO43-, HPO4deux-, HdeuxPO4-, Oh-), ainsi que le type d'impuretés dans le solide. Ainsi, jusqu'à onze phosphates de calcium ou plus, chacun avec sa propre structure et ses propres propriétés, peuvent être d'origine naturelle ou artificielle..
Certains phosphates et leurs structures et formules chimiques respectives seront mentionnés ci-dessous:
-Hydrogénophosphate de calcium dihydraté, CaHPO4∙ 2HdeuxO: monoclinique.
-Phosphate monosodique de calcium monohydraté, Ca (HdeuxPO4)deux∙ HdeuxOu: triclinique.
-Phosphate diacide anhydre, Ca (HdeuxPO4)deux: triclinique.
-Hydrogénophosphate d'octacalcium (OCP), Ca8Hdeux(PO4)6: triclinique. C'est un précurseur dans la synthèse de l'hydroxyapatite.
-Hydroxyapatite, Ca5(PO4)3OH: hexagonal.
Proprietes physiques et chimiques
Des noms
-Le phosphate de calcium
-Phosphate tricalcique
-Diphosphate tricalcique
Poids moléculaire
310,74 g / mol.
Description physique
C'est un solide blanc inodore.
Goût
Insipide.
Point de fusion
1670 ºK (1391 ºC).
Solubilité
-Pratiquement insoluble dans l'eau.
-Insoluble dans l'éthanol.
-Soluble dans l'acide chlorhydrique dilué et l'acide nitrique.
Densité
3,14 g / cm3.
Indice de réfraction
1 629
Enthalpie de formation standard
4126 kcal / mol.
Température de stockage
2 à 8 ºC.
pH
6-8 dans une suspension aqueuse de 50 g / L de phosphate de calcium.
Formation
Nitrate de calcium et hydrogénophosphate d'ammonium
Il existe de nombreuses méthodes pour produire ou former du phosphate de calcium. L'un d'eux consiste en un mélange de deux sels, Ca (NO3)deux∙ 4HdeuxO et (NH4)deuxHPO4, préalablement dissous dans de l'alcool absolu et de l'eau, respectivement. Un sel fournit du calcium et l'autre fournit du phosphate.
A partir de ce mélange, l'ACP précipite, qui est ensuite soumis à un chauffage dans une étuve à 800 ° C pendant 2 heures. À la suite de cette procédure, le β-Ca est obtenu3(PO4)deux. En contrôlant soigneusement les températures, l'agitation et les temps de contact, la formation de nanocristaux peut se produire.
Pour former le polymorphe α-Ca3(PO4)deux il faut chauffer le phosphate au dessus de 1000 ° C. Ce chauffage est effectué en présence d'autres ions métalliques, qui stabilisent suffisamment ce polymorphe pour qu'il puisse être utilisé à température ambiante; c'est-à-dire qu'il reste dans un état méta stable.
Hydroxyde de calcium et acide phosphorique
Le phosphate de calcium peut également être formé en mélangeant les solutions d'hydroxyde de calcium et d'acide phosphorique, produisant une neutralisation acido-basique. Après une demi-journée de maturation dans les liqueurs mères, et leur filtration, lavage, séchage et tamisage, on obtient une poudre de phosphate amorphe granulaire, ACP..
Cette réaction ACP produit des températures élevées, se transformant selon les équations chimiques suivantes:
2Ca9(HPO4) (PO4)5(OH) => 2Ca9(PdeuxOU ALORS7)0,5(PO4)5(OH) + HdeuxO (à T = 446,60 ° C)
2Ca9(PdeuxOU ALORS7)0,5(PO4)5(OH) => 3Ca3(PO4)deux + 0,5HdeuxO (à T = 748,56 ° C)
De cette manière, le β-Ca est obtenu3(PO4)deux, son polymorphe le plus commun et le plus stable.
Applications
Dans le tissu osseux
La CA3(PO4)deux c'est le principal constituant inorganique des cendres osseuses. C'est un composant des greffes de remplacement osseux, cela s'explique par sa similitude chimique avec les minéraux présents dans l'os.
Les biomatériaux de phosphate de calcium sont utilisés pour corriger les défauts osseux et dans le revêtement des prothèses métalliques en titane. Le phosphate de calcium s'y dépose, les isole de l'environnement et ralentit le processus de corrosion du titane..
Phosphates de calcium, y compris Ca3(PO4)deux, Ils sont utilisés pour fabriquer des matériaux céramiques. Ces matériaux sont biocompatibles et sont actuellement utilisés pour restaurer la perte osseuse alvéolaire résultant d'une maladie parodontale, d'infections endodontiques et d'autres conditions..
Cependant, ils ne doivent être utilisés que pour accélérer la réparation osseuse périapicale, dans les zones où il n'y a pas d'infection bactérienne chronique..
Le phosphate de calcium peut être utilisé pour réparer les défauts osseux lorsqu'une greffe osseuse autogène ne peut pas être utilisée. Il peut être utilisé seul ou en combinaison avec un polymère biodégradable et résorbable, tel que l'acide polyglycolique.
Ciments biocéramiques
Le ciment de phosphate de calcium (CPC) est un autre biocéramique utilisé dans la réparation du tissu osseux. Il est fabriqué en mélangeant la poudre de différents types de phosphates de calcium avec de l'eau, formant une pâte. La pâte peut être injectée ou adaptée au défaut osseux ou à la cavité.
Les ciments sont moulés, progressivement résorbés et remplacés par de l'os nouvellement formé.
Médecins
-La CA3(PO4)deux C'est un sel basique, il est donc utilisé comme antiacide pour neutraliser les brûlures d'estomac en excès et augmenter le pH. Dans les dentifrices, il fournit une source de calcium et de phosphate pour faciliter le processus de reminéralisation des dents et de l'hémostase osseuse.
-Il est également utilisé comme complément nutritionnel, bien que le moyen le moins cher de fournir du calcium soit d'utiliser son carbonate et son citrate..
-Le phosphate de calcium peut être utilisé dans le traitement de la tétanie, de l'hypocalcémie latente et du traitement d'entretien. De plus, il est utile dans la supplémentation en calcium pendant la grossesse et l'allaitement..
-Il est utilisé dans le traitement de la contamination par les isotopes radioactifs radium (Ra-226) et strontium (Sr-90). Le phosphate de calcium bloque l'absorption des isotopes radioactifs dans le tube digestif, limitant ainsi les dommages qu'ils provoquent.
Autres
-Le phosphate de calcium est utilisé comme aliment pour les oiseaux. De plus, il est utilisé dans les dentifrices pour contrôler le tartre..
-Il est utilisé comme agent anti-agglomérant, par exemple pour empêcher le sel de table de se compacter.
-Il fonctionne comme agent de blanchiment pour la farine. Pendant ce temps, dans le saindoux, il empêche la coloration indésirable et améliore les conditions de friture..
Les références
- Tung M.S. (1998) Phosphates de calcium: structure, composition, solubilité et stabilité. Dans: Amjad Z. (eds) Calcium Phosphates in Biological and Industrial Systems. Springer, Boston, MA.
- Langlang Liu, Yanzeng Wu, Chao Xu, Suchun Yu, Xiaopei Wu et Honglian Dai. (2018). "Synthèse, caractérisation du phosphate de nano-β-tricalcique et l'inhibition sur les cellules de carcinome hépatocellulaire," Journal of Nanomaterials, vol. 2018, Article ID 7083416, 7 pages, 2018.
- Combes, Christ et Rey, Christian. (2010). Phosphates de calcium amorphes: synthèse, propriétés et utilisations dans les biomatériaux. Acta Biomaterialia, vol. 6 (n ° 9). pp. 3362-3378. ISSN 1742-7061
- Wikipédia. (2019). Phosphate tricalcique. Récupéré de: en.wikipedia.org
- Abida et coll. (2017). Poudre de phosphate tricalcique: capacités de préparation, de caractérisation et de compactage. Journal méditerranéen de chimie 2017, 6 (3), 71-76.
- PubChem. (2019). Le phosphate de calcium. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Elsevier. (2019). Le phosphate de calcium. Science Direct. Récupéré de: sciencedirect.com



Personne n'a encore commenté ce post.