
Formule condensée ce que c'est et exemples (méthane, éthane, glucose ...)
La formule condensée c'est une représentation purement textuelle d'une molécule dans laquelle les liens sont omis. Son but est de permettre de savoir quel est l'ordre des atomes. Généralement, les molécules linéaires ou ramifiées ont des formules condensées, à l'exception des molécules cycliques ou de celles qui sont hautement ramifiées..
En chimie organique, il y a souvent confusion quant à la différence entre cette formule et la formule moléculaire. En fait, il est courant de les trouver comme synonymes. Pendant ce temps, en chimie inorganique, les formules moléculaires sont davantage utilisées, car dans la plupart des cas, elles décrivent avec précision des composés covalents; comme l'eau, HdeuxOU ALORS.
Index des articles
- 1 Quelle est la formule condensée?
- 2 exemples
- 2.1 Méthane
- 2,2 éthane
- 2.3 Glucose et fructose
- 2.4 Butane
- 2.5 Éthanol
- 2.6 Pentane
- 2,7 octane
- 2.8 Cyclohexane
- 2.9 Acétone
- 2.10 Acide acétique
- 3 Observation générale
- 4 Références
Quelle est la formule condensée?
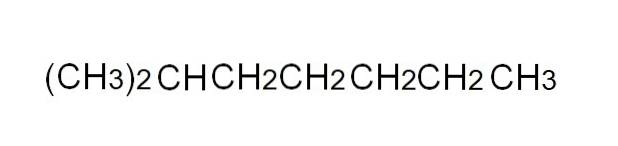
Pour la définir plus commodément, la formule condensée est une représentation simplifiée de la formule semi-développée. Il n'est pas nécessaire d'écrire des liens uniques, ni de s'étendre sur plus d'une ligne dans un texte. Par exemple, le 2-méthylheptane, un alcane ramifié, peut être représenté sur la même ligne que dans l'image ci-dessus.
Les formules condensées sont utiles pour représenter certaines molécules sans avoir à les dessiner. Ceci est excellent lors de l'écriture d'équations chimiques dans lesquelles des molécules hautement ramifiées ou cycliques ne sont pas impliquées. On verra que ces formules utilisent des parenthèses pour simplifier davantage la représentation d'une molécule.
Exemples
Méthane
Le méthane est le seul composé chimique qui a une seule formule: CH4. Cela correspond à la fois empirique, moléculaire, condensé et semi-développé. C'est pourquoi de nombreuses fois, pour éviter toute confusion entre tous ces concepts, les gens préfèrent se référer simplement et de manière imprécise à la `` formule chimique '' d'un composé.
Éthane
L'éthane a la formule moléculaire CdeuxH6. La formule condensée est à la place CH3CH3. Notez que la liaison C-C et les liaisons C-H sont omises. L'idée est de pouvoir écrire la formule comme s'il s'agissait d'un «mot», sans avoir à tracer des lignes ou à dessiner des structures.
Par définition, la formule moléculaire est CdeuxH6 et pas CH3CH3; Cependant, pour les molécules simples, les deux formules sont utilisées pour interchanger, bien que ce soit toujours incorrect. C'est un point de divergence entre les différentes sources, où apparemment il n'y a pas de règles spécifiques à cet égard..
Glucose et fructose
Voici un exemple où une erreur est immédiatement observée lorsque l'on souhaite échanger la formule moléculaire pour la formule condensée.
Le couple sucré, glucose et fructose, a la même formule moléculaire: C6H12OU ALORS6, et donc cela ne sert pas à les différencier. En revanche, les formules structurales et semi-développées établissent visuellement qu'il s'agit de molécules différentes.
Cependant, ni le glucose ni le fructose n'ont de formule condensée. En effet, quelle que soit leur représentation ou projection, leurs structures ne peuvent pas être écrites sur la même ligne; ou du moins d'une manière agréable et simple aux yeux du lecteur.
Butane
Le butane a la formule moléculaire C4Hdix. Il a deux isomères: le linéaire, n-le butane et le 2-méthylpropane ramifié. Les deux peuvent être représentés par leurs formules condensées. le n-le butane est CH3CHdeuxCHdeuxCH3 ou CH3(CHdeux)deuxCH3, et le 2-méthylpropane est CH3CH (CH3)deux ou (CH3)3CH.
Dans le 2-méthylpropane, nous avons un groupe CH entouré de trois CH3. Ses deux formules sont valides, et des parenthèses sont utilisées pour mettre en évidence les branches, l'indice étant un indicateur du nombre de groupes composant ladite branche.
Éthanol
L'éthanol a la formule condensée CH3CHdeuxOH. Notez à quel point il ressemble à sa formule semi-développée: CH3-CHdeux-OH. La même chose est faite avec le propanol, CH3CHdeuxCHdeuxOh le n-butanol, CH3CHdeuxCHdeuxCHdeuxOH, et avec tous les autres alcools.
S'ils ont une branche, elle sera indiquée entre parenthèses à droite de l'atome auquel elle est liée. Par exemple, le 2-méthylbutanol pourrait s'écrire: CH3CHdeuxCH (CH3) CHdeuxOH. A noter que pour de nombreuses molécules, il devient plus pratique de recourir à une formule structurelle ou semi-développée.
Pentane
L'isomère linéaire du pentane, n-pentane, il est facile à représenter par sa formule condensée: CH3CHdeuxCHdeuxCHdeuxCH3. Cette formule peut également être simplifiée en utilisant des parenthèses: CH3(CHdeux)3CH3, indiquant qu'entre les deux CH3 il y a trois CHdeux.
Les deux autres isomères du pentane sont cependant un peu plus compliqués: CH3CHdeuxCH (CH3)deux, pour le 2-méthylbutane et C (CH3)4 pour le 2,2-diméthylpropane ou le néopentane. Notez que l'atome de carbone à gauche des parenthèses est celui qui forme des liaisons avec les substituants ou les branches..
Octane
L'isomère linéaire de l'octane, n-octane, en raison de sa longueur, il convient maintenant de représenter sa formule condensée comme CH3(CHdeux)6CH3. C'est à ce stade que quelque chose doit être clair sur les formules condensées: elles cherchent à gagner du temps lors de la représentation de molécules ou de composés, sans avoir à écrire autant sur le papier..
Cyclohexane
Le cas du cyclohexane est similaire à celui du glucose et du fructose: il manque formellement de formule condensée car il s'agit d'un composé cyclique. Une façon d'essayer de le représenter serait: (CHdeux)6, ce qui suggère que six groupes CHdeux doivent être liés, n'étant possible que s'ils sont fermés dans un anneau hexagonal. Cependant, il vaut mieux dessiner l'anneau.
Acétone
L'acétone a la particularité d'avoir un groupe carbonyle, C = O. Par conséquent, pour écrire sa formule condensée, nous avons trois options: (CH3)deuxCO, CH3C (O) CH3 ou CH3(C = O) CH3.
En fait, dans les molécules plus grosses, le groupe carbonyle est généralement représenté par (O), en tenant compte du fait que l'atome de carbone à sa gauche est celui qui forme la double liaison avec l'oxygène, C = O.
Acide acétique
La formule condensée de l'acide acétique est CH3COOH ou CH3COdeuxH. Un point important se dégage ici: les groupes fonctionnels écrits sur la même ligne font partie d'une formule condensée. C'était le cas de l'éthanol et de l'acétone, et s'applique également aux thiols (-SH), aux aldéhydes (-CHO), aux esters (-COdeuxR ou -COOR) et les amines (-NHdeux).
Commentaire général
Il y a beaucoup de confusion entre les formules moléculaires et condensées. C'est peut-être parce que ces représentations à elles seules fournissent déjà une image approximative de la molécule, c'est pourquoi nous pensons que c'est la formule moléculaire.
De même, des formules comme C6H12OU ALORS6 ils sont également considérés comme condensés, car ils y sont simplifiés, la molécule est "condensée" en atomes et indices. C'est pourquoi il est courant de voir comment les deux formules sont mentionnées comme s'il s'agissait de synonymes.
Dans de nombreuses sources, y compris les articles de Wikipédia, les termes `` formule chimique '' sont utilisés pour désigner la molécule (type C6H12OU ALORS6 et autres), et `` formule '' pour désigner le condensé.
Les références
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE.
- Helmenstine, Anne Marie, Ph.D. (18 novembre 2019). Définition de formule condensée en chimie. Récupéré de: thinkco.com
- James Ashenhurst. (11 décembre 2019). Formules condensées: déchiffrer ce que signifient les parenthèses. Master chimie organique. Récupéré de: masterorganicchemistry.com
- Co-ingénierie. (2 mai 2016). Formule empirique, structurelle et condensée. Récupéré de: quimiotecablog.wordpress.com
- Introduction à la chimie: générale, organique et biologique. (s.f.). Formules de structure et d'angle de ligne condensées. Récupéré de: 2012books.lardbucket.org



Personne n'a encore commenté ce post.