
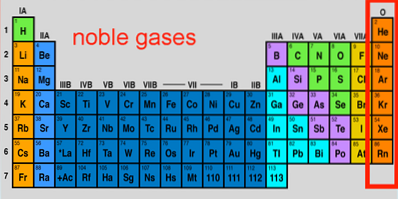
Caractéristiques des gaz nobles, configuration, réactions, utilisations

Les gaz nobles Il s'agit d'un ensemble d'éléments qui se trouvent dans le groupe 18 du tableau périodique. Au fil des ans, ils ont également été appelés gaz rares ou inertes, qui sont tous deux inexacts; certains d'entre eux sont très abondants à l'extérieur et à l'intérieur de la planète Terre, et ils sont également capables, dans des conditions extrêmes, de réagir.
Ses sept éléments constituent peut-être le groupe le plus unique du tableau périodique, dont les propriétés et les faibles réactivités sont aussi impressionnantes que celles des métaux nobles. Parmi eux défilent l'élément le plus inerte (néon), le deuxième le plus abondant du Cosmos (hélium), et le plus lourd et le plus instable (oganeson).

Les gaz nobles sont les substances les plus froides de la nature; résister à de très basses températures avant de se condenser. Son gel est encore plus difficile, car ses forces intermoléculaires basées sur la diffusion de Londres et la polarisabilité de ses atomes sont trop faibles pour à peine les garder cohésives dans un cristal..
En raison de leur faible réactivité, ce sont des gaz relativement sûrs à stocker et ne présentent pas trop de risques. Cependant, ils peuvent déplacer l'oxygène des poumons et provoquer une suffocation s'ils sont inhalés de manière excessive. D'autre part, deux de ses membres sont des éléments hautement radioactifs et, par conséquent, mortels pour la santé..
La faible réactivité des gaz rares est également utilisée pour fournir aux réactions une atmosphère inerte; de sorte qu'aucun réactif ou produit ne risque de s'oxyder et d'affecter les performances de la synthèse. Cela favorise également les procédés de soudage à l'arc électrique..
En revanche, à l'état liquide, ce sont d'excellents fluides frigorigènes cryogéniques qui garantissent les températures les plus basses, indispensables au bon fonctionnement des équipements hautement énergétiques, ou pour que certains matériaux atteignent des états de supraconductivité..
Index des articles
- 1 Caractéristiques des gaz rares
- 2 Les 7 gaz rares
- 3 Configuration électronique
- 4 Polarisabilité
- 5 réactions
- 5.1 Hélium et néon
- 5.2 Argon et krypton
- 5.3 Xénon et radon
- 6 Production
- 6.1 Liquéfaction de l'air
- 6.2 Distillation de gaz naturel et de minéraux radioactifs
- 7 dangers
- 8 utilisations
- 8.1 Industrie
- 8.2 Ballons et réservoirs respiratoires
- 8.3 Médecine
- 8.4 Autres
- 9 Références
Caractéristiques des gaz nobles
Les gaz nobles sont peut-être les éléments qui partagent le plus de qualités en commun, à la fois physiques et chimiques. Ses principales caractéristiques sont:
- Tous sont incolores, inodores et insipides; mais lorsqu'ils sont enfermés dans des ampoules à basse pression et qu'ils reçoivent un choc électrique, ils s'ionisent et émettent des lumières colorées (image du haut).
- Chaque gaz rare a sa propre lumière et son spectre.
- Ce sont des espèces monatomiques, les seules du tableau périodique qui peuvent exister dans leurs états physiques respectifs sans la participation de liaisons chimiques (puisque les métaux sont joints par des liaisons métalliques). Par conséquent, ils sont parfaits pour étudier les propriétés des gaz, car ils s'adaptent très bien au modèle sphérique d'un gaz parfait..
- Ce sont généralement les éléments avec les points de fusion et d'ébullition les plus bas; à tel point que l'hélium ne peut même pas cristalliser au zéro absolu sans augmentation de la pression.
- De tous les éléments, ils sont les moins réactifs, encore moins que les métaux nobles.
- Leurs énergies d'ionisation sont les plus élevées, ainsi que leurs électronégativités, en supposant qu'elles forment des liaisons purement covalentes..
- Ses rayons atomiques sont également les plus petits car ils sont aux extrémités droites de chaque période..
Les 7 gaz rares
Les sept gaz rares sont, de haut en bas, descendant dans le groupe 18 du tableau périodique:
-Hélium, il
-Néon, Ne

-Argon, Ar
-Krypton, Kr
-Xénon, Xe

-Radon, Rn
-Oganeson, Og
Tous, à l'exception de l'oganeson instable et artificiel, ont été étudiés pour leurs propriétés physiques et chimiques. On pense que l'Oganeson, en raison de sa grande masse atomique, n'est même pas un gaz, mais un liquide ou un solide noble. On sait peu de choses sur le radon, en raison de sa radioactivité, par rapport à l'hélium ou à l'argon.
Configuration électronique
On a dit que les gaz nobles avaient leur coquille de valence complètement remplie. À tel point que leurs configurations électroniques sont utilisées pour simplifier celle d'autres éléments en utilisant leurs symboles entre crochets ([He], [Ne], [Ar], etc.). Ses configurations électroniques sont:
-Hélium: 1sdeux, [He] (2 électrons)
-Néon: 1sdeux2 sdeux2 P6, [Ne] (10 électrons)
-Argon: 1sdeux2 sdeux2 P63 sdeux3p6, [Ar] (18 électrons)
-Krypton: 1sdeux2 sdeux2 P63 sdeux3p63ddix4 sdeux4p6, [Kr] (36 électrons)
-Xénon: 1 sdeux2 sdeux2 P63 sdeux3p63ddix4 sdeux4p64jdix5 sdeux5 p6, [Xe] (54 électrons)
-Radon: 1sdeux2 sdeux2 P63 sdeux3p63ddix4 sdeux4p64jdix4f145 sdeux5 p65 jdix6 sdeux6p6, [Rn] (86 électrons)
L'important n'est pas de s'en souvenir, mais de détailler qu'ils se terminent par nsdeuxnp6: l'octet de valence. De même, il est apprécié que ses atomes ont de nombreux électrons qui, en raison de la grande force nucléaire effective, se trouvent dans un volume plus petit que celui des autres éléments; c'est-à-dire que leurs rayons atomiques sont plus petits.
Par conséquent, leurs rayons atomiques électroniquement denses présentent une caractéristique chimique que tous les gaz rares partagent: ils sont difficiles à polariser..
Polarisabilité
Les gaz nobles peuvent être imaginés comme des sphères de nuages d'électrons. En descendant dans le groupe 18, ses rayons augmentent, et de la même manière la distance qui sépare le noyau des électrons de valence (ceux des nsdeuxnp6).
Ces électrons, en ressentant une force moins attractive de la part du noyau, peuvent se déplacer plus librement; les sphères se déforment plus facilement plus elles sont volumineuses. En conséquence de tels mouvements, des régions de densités électroniques faibles et élevées apparaissent: les pôles δ + et δ-.
Lorsque l'atome d'un gaz rare est polarisé, il devient un dipôle instantané capable d'en induire un autre à l'atome voisin; c'est-à-dire que nous sommes confrontés aux forces dispersives de Londres.
C'est pourquoi les forces intermoléculaires augmentent de l'hélium au radon, ce qui se traduit par l'augmentation de leur point d'ébullition; et pas seulement cela, mais leurs réactivités sont également augmentées.
À mesure que les atomes deviennent plus polarisés, il y a une plus grande possibilité que leurs électrons de valence participent à des réactions chimiques, après quoi des composés de gaz rares sont générés..
Réactions
Hélium et néon
Parmi les gaz rares, les moins réactifs sont l'hélium et le néon. En fait, le néon est l'élément le plus inerte de tous, même si son électronégativité (due à la formation de liaisons covalentes) dépasse celle du fluor.
Aucun de ses composés n'est connu dans des conditions terrestres; Cependant, dans le Cosmos, l'existence de l'ion moléculaire HeH est assez probable+. De même, lorsqu'ils sont excités électroniquement, ils sont capables d'interagir avec des atomes gazeux et de former des molécules neutres à courte durée de vie appelées excimères; tels que HeNe, CsNe et Nedeux.
D'autre part, bien qu'ils ne soient pas considérés comme des composés au sens formel, les atomes He et Ne peuvent donner naissance à des molécules de Van der Walls; c'est-à-dire des composés qui sont maintenus «ensemble» simplement par des forces de dispersion. Par exemple: Ag3Il, HeCO, HeIdeux, CF4Ne, Ne3Cldeux et NeBeCO3.
De même, de telles molécules de Van der Walls peuvent exister grâce à de faibles interactions dipolaires induites par les ions; par exemple: Na+j'ai8, Rb+Lui, Cu+Ne3 et Cu+Ne12. A noter qu'il est même possible que ces molécules deviennent des agglomérats d'atomes: amas.
Et enfin, les atomes He et Ne peuvent être «piégés» ou intercalés dans des complexes endoédriques de fullerènes ou de clathrates, sans réagir; par exemple: [email protected]60, (Ndeux)6Ne7, Il hdeuxOU ALORS)6 et Ne • NH4Fe (HCOO)3.
Argon et krypton
Les gaz rares argon et krypton, parce qu'ils sont plus polarisables, ont tendance à présenter plus de «composés» que l'hélium et le néon. Cependant, une partie d'entre eux sont plus stables et caractérisables, car ils ont une durée de vie plus longue. Parmi certains d'entre eux se trouve HArF et l'ion moléculaire ArH+, présente dans les nébuleuses par l'action des rayons cosmiques.
Du krypton commence la possibilité d'obtenir des composés dans des conditions extrêmes, mais durables. Ce gaz réagit avec le fluor selon l'équation chimique suivante:
Kr + Fdeux → KrFdeux
Notez que le krypton acquiert un nombre d'oxydation de +2 (Krdeux+) grâce au fluorure. Le KrFdeux en fait, il peut être synthétisé en quantités commercialisables en tant qu'agent oxydant et fluoré.
L'argon et le krypton peuvent établir un large répertoire de clathrates, de complexes endoédriques, de molécules de Van der Walls et de certains composés en attente de découverte après leur existence prévue..
Xénon et radon
Le xénon est, parmi les gaz rares, le roi de la réactivité. Il forme les composés vraiment stables, commercialisables et caractérisables. En fait, sa réactivité ressemble à celle de l'oxygène dans les conditions appropriées..
Son premier composé synthétisé était «XePtF6", En 1962 par Neil Bartlett. Ce sel était en fait, selon la littérature, constitué d'un mélange complexe d'autres sels fluorés de xénon et de platine.
Cependant, cela était plus que suffisant pour démontrer l'affinité entre le xénon et le fluor. Parmi certains de ces composés, nous avons: XeFdeux, XeF4, XeF6 et [XeF]+[PtF5]-. Quand le XeF6 se dissout dans l'eau, génère un oxyde:
XeF6 + 3 HdeuxO → XeO3 + 6 HF
Ce XeO3 peut être à l'origine de l'espèce connue sous le nom de xenatos (HXeO4-) ou l'acide xénique (HdeuxXeO4). Xenates disproportionnés par rapport aux perxénates (XeO64-); et si le milieu est ensuite acidifié, en acide peroxénique (H4XeO6), qui est déshydraté en tétroxyde de xénon (XeO4):
H4XeO6 → 2 HdeuxO + XeO4
Le radon devrait être le plus réactif des gaz nobles; Mais il est si radioactif qu'il n'a guère le temps de réagir avant de se désintégrer. Les seuls composés entièrement synthétisés sont son fluorure (RnFdeux) et oxyde (RnO3).
Production
Liquéfaction de l'air
Les gaz rares deviennent plus abondants dans l'Univers à mesure que nous descendons dans le groupe 18. Dans l'atmosphère, cependant, l'hélium est rare, car le champ gravitationnel de la Terre ne peut pas le retenir contrairement aux autres gaz. C'est pourquoi il n'a pas été détecté dans l'air mais au soleil.
D'autre part, dans l'air, il y a des quantités notables d'argon, provenant de la désintégration radioactive du radio-isotope 40L'air est la source naturelle la plus importante d'argon, de néon, de krypton et de xénon sur la planète.
Pour les produire, l'air doit d'abord être liquéfié afin qu'il se condense en liquide. Ensuite, ce liquide subit une distillation fractionnée, séparant ainsi chacun des composants de son mélange (Ndeux, OU ALORSdeux, COdeux, Ar, etc.).
En fonction de la température et de l'abondance du gaz, ses prix augmentent, classant le xénon comme le plus cher, tandis que l'hélium est le moins cher..
Distillation de gaz naturel et de minéraux radioactifs
L'hélium, quant à lui, est obtenu à partir d'une autre distillation fractionnée; mais pas de l'air, mais du gaz naturel, enrichi en hélium grâce à la libération de particules alpha des minéraux radioactifs thorium et uranium.
De même, le radon est «né» de la désintégration radioactive du radium dans ses minéraux respectifs; mais en raison de leur faible abondance et de la courte demi-vie des atomes de Rn, leur abondance est risible par rapport à celle de leurs congénères (les autres gaz nobles).
Enfin, l'oganeson est un «gaz» noble artificiel, ultramassique et hautement radioactif qui ne peut exister que brièvement dans des conditions contrôlées au sein d'un laboratoire..
Les dangers
Le principal risque des gaz rares est qu'ils limitent l'utilisation de l'oxygène par l'homme, en particulier lorsqu'une atmosphère à forte concentration de ceux-ci est produite. C'est pourquoi il n'est pas recommandé de les inhaler excessivement..
Aux États-Unis, une forte concentration de radon a été détectée dans des sols riches en uranium, ce qui en raison de ses caractéristiques radioactives pourrait constituer un risque pour la santé.
Applications
Industrie
L'hélium et l'argon sont utilisés pour créer une atmosphère inerte pour la protection pendant le soudage et le découpage. De plus, ils sont utilisés dans la fabrication de semi-conducteurs en silicium. L'hélium est utilisé comme gaz de remplissage dans les thermomètres.
L'argon, associé à l'azote, est utilisé dans la fabrication de lampes à incandescence. Le krypton mélangé à des halogènes, tels que le brome et l'iode, est utilisé dans les lampes à décharge. Le néon est utilisé dans les enseignes lumineuses, mélangé à des phosphores et à d'autres gaz pour teinter sa couleur rouge.
Le xénon est utilisé dans les lampes à arc qui émettent une lumière qui ressemble à la lumière du jour, qui sont utilisées dans les phares et les projecteurs de voiture. Les gaz rares sont mélangés avec des halogènes pour produire ArF, KrF ou XeCl, qui sont utilisés dans la production de lasers excimères.
Ce type de laser produit une lumière ultraviolette à ondes courtes qui produit des images de haute précision et est utilisé dans la fabrication de circuits intégrés. L'hélium et le néon sont utilisés comme gaz réfrigérants cryogéniques.
Ballons et réservoirs respiratoires
L'hélium est utilisé comme substitut de l'azote dans le mélange de gaz respiratoire, en raison de sa faible solubilité dans l'organisme. Cela évite la formation de bulles lors de la phase de décompression lors de la remontée, en plus d'éliminer la narcose azotée.
L'hélium a remplacé l'hydrogène comme gaz qui permet l'élévation des dirigeables et des ballons à air chaud, car c'est un gaz léger et incombustible..
Médicament
L'hélium est utilisé dans la fabrication d'aimants supraconducteurs utilisés dans les équipements de résonance magnétique nucléaire: un outil multi-applications en médecine.
Le krypton est utilisé dans les lampes halogènes utilisées dans la chirurgie oculaire au laser et l'angioplastie. L'hélium est utilisé pour faciliter la respiration chez les patients asthmatiques.
Le xénon est utilisé comme anesthésique en raison de sa grande solubilité lipidique et est considéré comme l'anesthésique du futur. Le xénon est également utilisé en imagerie médicale pulmonaire.
Le radon, un gaz noble radioactif, est utilisé en radiothérapie pour certains types de cancer.
Autres
L'argon est utilisé dans la synthèse de composés remplaçant l'azote comme atmosphère inerte. L'hélium est utilisé comme gaz vecteur en chromatographie en phase gazeuse, ainsi que dans les compteurs Geiger pour mesurer le rayonnement.
Les références
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE.
- Helmenstine, Anne Marie, Ph.D. (06 juin 2019). Propriétés, utilisations et sources des gaz nobles. Récupéré de: thinkco.com
- Wikipédia. (2019). Gaz rare. Récupéré de: en.wikipedia.org
- Philip Ball. (18 janvier 2012). Chimie impossible: forcer les gaz rares à fonctionner. Récupéré de: newscientist.com
- Professeur Patricia Shapley. (2011). Chimie des gaz nobles. Récupéré de: butane.chem.uiuc.edu
- Gary J. Schrobilgen. (28 février 2019). Gaz rare. Encyclopædia Britannica. Récupéré de: britannica.com


Personne n'a encore commenté ce post.