
Caractéristiques du groupe carbonyle, propriétés, nomenclature, réactivité
le groupe carbonyle C'est un groupe fonctionnel organique et oxygéné qui ressemble à la molécule de monoxyde de carbone gazeux. Il est représenté par C = O, et bien qu'il soit considéré comme organique, il peut également être trouvé dans des composés inorganiques; comme acide carbonique, HdeuxCO3, ou dans des composés organométalliques avec CO comme liant.
Cependant, c'est dans la chimie du carbone, de la vie, de la biochimie et d'autres branches scientifiques similaires que ce groupe se distingue par son énorme importance. Sans lui, de nombreuses molécules ne pourraient pas interagir avec l'eau; les protéines, sucres, acides aminés, graisses, acides nucléiques et autres biomolécules n'existeraient pas sans lui.
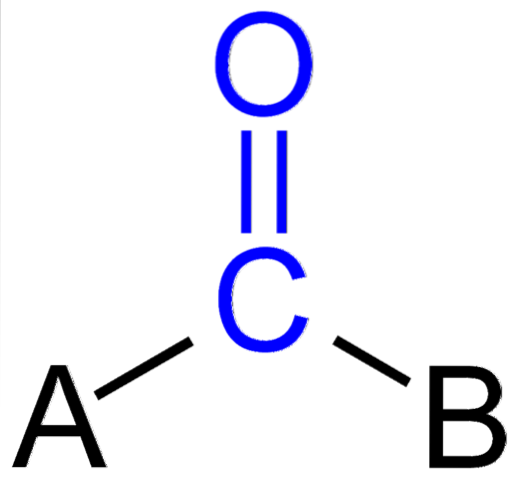
L'image ci-dessus montre à quoi ressemble ce groupe dans le squelette général d'un composé. Notez qu'il est mis en évidence par la couleur bleue, et si nous supprimions les substituants A et B (R ou R ', également valables), une molécule de monoxyde de carbone resterait. La présence de ces substituants définit un grand nombre de molécules organiques.
Si A et B sont des atomes autres que le carbone, tels que des métaux ou des éléments non métalliques, on peut avoir des composés organométalliques ou inorganiques, respectivement. Dans le cas de la chimie organique, les substituants A et B seront toujours soit des atomes d'hydrogène, des chaînes carbonées, des lignes, avec ou sans ramifications, des cycles cycliques ou aromatiques..
C'est ainsi qu'il commence à comprendre pourquoi le groupe carbonyle est assez courant pour ceux qui étudient les sciences naturelles ou de la santé; il est partout, et sans lui les mécanismes moléculaires qui se produisent dans nos cellules ne se produiraient pas.
Si sa pertinence pouvait être résumée, on dirait qu'elle contribue à la polarité, à l'acidité et à la réactivité d'une molécule. Là où il y a un groupe carbonyle, il est plus que probable que juste à ce point, la molécule puisse subir une transformation. C'est donc un site stratégique pour développer la synthèse organique par oxydation ou attaques nucléophiles..
Index des articles
- 1 Caractéristiques et propriétés du groupe carbonyle
- 1.1 Structures de résonance
- 2 Nomenclature
- 3 Réactivité
- 3.1 Attaque nucléophile
- 3.2 Réduction
- 3.3 Formation d'acétals et de cétals
- 4 types
- 5 Comment l'identifier dans les aldéhydes et les cétones
- 5.1 Identification
- 6 Principaux exemples
- 7 Références
Caractéristiques et propriétés du groupe carbonyle
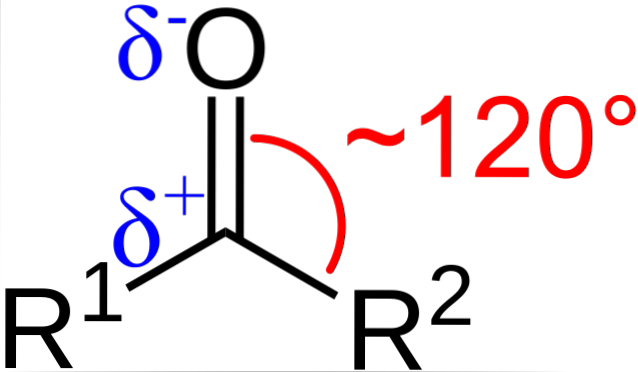
Quelles sont les caractéristiques structurelles et électroniques du groupe carbonyle? Ci-dessus peut être vu, maintenant en utilisant les lettres R1 et Rdeux au lieu de A et B, il y a un angle de 120 ° C entre les substituants et l'atome d'oxygène; c'est-à-dire que la géométrie autour de ce groupe est un plan trigonal.
Pour qu'une telle géométrie soit les atomes de carbone et d'oxygène doivent nécessairement avoir une hybridation chimique spdeux; ainsi le carbone aura trois orbitales spdeux pour former de simples liaisons covalentes avec R1 et Rdeux, et une orbitale p pur pour établir la double liaison avec l'oxygène.
Ceci explique comment il peut y avoir une double liaison C = O.
Si l'image est observée, on verra également que l'oxygène a une densité d'électrons, δ-, plus élevée que le carbone, δ +. Cela est dû au fait que l'oxygène est plus électronégatif que le carbone, et par conséquent le "prive" de la densité électronique; et pas seulement lui, mais aussi les substituants R1 et Rdeux.
Par conséquent, un moment dipolaire permanent est généré, qui peut être de plus ou moins grande ampleur en fonction de la structure moléculaire. Partout où il y a un groupe carbonyle, il y aura des moments dipolaires.
Structures de résonance
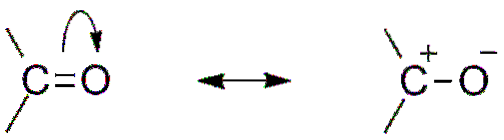
Une autre conséquence de l'électronégativité de l'oxygène est que dans le groupe carbonyle, il existe des structures de résonance qui définissent un hybride (la combinaison des deux structures dans l'image supérieure). Notez que la paire d'électrons peut migrer vers l'orbitale p l'oxygène, qui quitte l'atome de carbone avec une charge partielle positive; un carbocation.
Les deux structures se succèdent constamment, de sorte que le carbone maintient une carence constante en électrons; c'est-à-dire que pour les cations qui en sont très proches, ils subiront une répulsion électrostatique. Mais, s'il s'agit d'un anion, ou d'une espèce capable de donner des électrons, vous ressentirez une forte attirance pour ce carbone..
Ensuite, ce que l'on appelle l'attaque nucléophile se produit, ce qui sera expliqué dans une prochaine section.
Nomenclature
Lorsqu'un composé a le groupe C = O, on dit qu'il est carbonyle. Ainsi, selon la nature du composé carbonyle, il a ses propres règles de nomenclature.
Bien que, quoi qu'il en soit, ils partagent tous une règle commune: C = O a la priorité dans la chaîne carbonée lors de la liste des atomes de carbone.
Cela signifie que s'il y a des ramifications, des atomes d'halogène, des groupes fonctionnels azotés, des doubles ou triples liaisons, aucun d'entre eux ne peut porter un numéro de localisateur inférieur à C = O; par conséquent, la chaîne la plus longue commence à être dénombrée aussi près que possible du groupe carbonyle.
Si, d'autre part, il y a plusieurs C = O dans la chaîne et que l'un d'eux fait partie d'un groupe fonctionnel supérieur, alors le groupe carbonyle portera un localisateur plus grand et sera mentionné comme un substituant oxo..
Et quelle est cette hiérarchie? Les éléments suivants, du plus élevé au plus bas:
-Acides carboxyliques, RCOOH
-Ester, RCOOR '
-Amida, RCONHdeux
-Aldéhyde, RCOH (ou RCHO)
-Cétone, RCOR
En substituant R et R 'aux segments moléculaires, une myriade de composés carbonylés sont originaires représentés par les familles ci-dessus: acides carboxyliques, esters, amides, etc. Chacun a sa nomenclature traditionnelle ou IUPAC qui lui est associée..
Réactivité
Attaque nucléophile
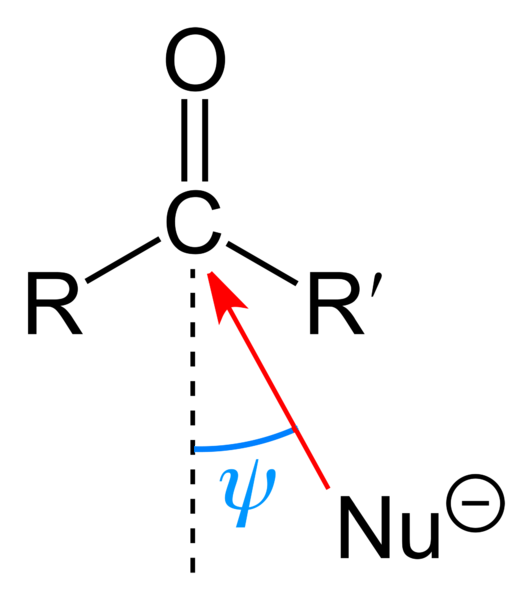
L'image du haut montre l'attaque nucléophile subie par le groupe carbonyle. Le nucléophile, Nu-, il peut s'agir d'un anion ou d'une espèce neutre avec des paires d'électrons disponibles; comme l'ammoniaque, NH3, par exemple. Il recherche exclusivement du carbone car, selon les structures de résonance, il a une charge partielle positive.
La charge positive attire Nu-, qui cherchera à se rapprocher par un "flanc" tel qu'il y ait le moins d'empêchement stérique des substituants R et R '. En fonction de leur volume ou de la taille du Nu-, l'attaque se produira sous différents angles ψ; peut être très ouvert ou fermé.
Une fois que l'attaque se produit, un composé intermédiaire se forme, Nu-CRR'-O-; c'est-à-dire que l'oxygène est laissé avec une paire d'électrons pour permettre à Nu d'être ajouté- groupe carbonyle.
Cet oxygène chargé négativement peut intervenir dans d'autres étapes de la réaction; protoné sous forme de groupe hydroxyle, OH, ou libéré sous forme de molécule d'eau.
Les mécanismes mis en jeu, ainsi que les produits de réaction obtenus par cette attaque, sont très variés..
Dérivés
L'agent nucléophile Nu- il peut s'agir de plusieurs espèces. Pour chacun d'eux spécifiquement, lors de la réaction avec le groupe carbonyle, différents dérivés proviennent.
Par exemple, lorsque ledit agent nucléophile est une amine, NHdeuxR, les imines sont originaires, RdeuxC = NR; s'il s'agit d'hydroxylamine, NHdeuxOH, donne lieu à des oximes, RR'C = NOH; s'il s'agit de l'anion cyanure, CN-, des cyanohydrines sont produites, RR'C (OH) CN, et ainsi de suite avec d'autres espèces.
Réduction
Au début, il a été dit que ce groupe est oxygéné, et donc oxydé. Cela signifie que, compte tenu des conditions, il peut être réduit ou perdre des liaisons avec l'atome d'oxygène en le remplaçant par des hydrogènes. Par exemple:
C = O => CHdeux
Cette transformation indique que le groupe carbonyle a été réduit en un groupe méthylène; il y avait un gain d'hydrogène à la suite de la perte d'oxygène. En termes chimiques plus appropriés: le composé carbonyle est réduit en alcane.
S'il s'agit d'une cétone, RCOR », en présence d'hydrazine, HdeuxN-NHdeux, et un milieu fortement basique peut être réduit en son alcane respectif; Cette réaction est connue sous le nom de réduction de Wolff-Kishner:
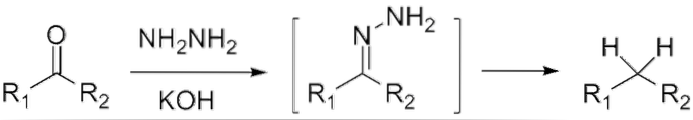
Si, au contraire, le mélange réactionnel est constitué de zinc amalgamé et d'acide chlorhydrique, la réaction est appelée réduction de Clemmensen:
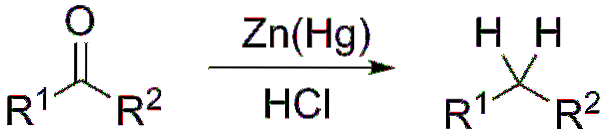
Formation d'acétals et de cétals
Le groupe carbonyle peut non seulement ajouter des agents nucléophiles Nu-, mais dans des conditions acides, il peut également réagir avec les alcools par des mécanismes similaires.
Lorsqu'un aldéhyde ou une cétone réagit partiellement avec un alcool, des hémiacétals ou des hémicétals sont produits, respectivement. Si la réaction est terminée, les produits sont des acétals et des cétals. Les équations chimiques suivantes résument et clarifient ce qui vient d'être mentionné:
RCHO + R3OH g RCHOH (OU3) (Hémiacétal) + R4OH g RCH (OU3) (OU ALORS4) (Acétal)
RCORdeux + R3OH g RCORdeux(OH) (OU3) (Hémicétal) + R4OH g RCORdeux(OU ALORS3) (OU ALORS4) (cétal)
La première réaction correspond à la formation d'hémiacétals et d'acétals à partir d'un aldéhyde, et la seconde d'hémicétals et de cétals à partir d'une cétone.
Ces équations peuvent ne pas être assez simples pour expliquer la formation de ces composés; Cependant, pour une première approche du sujet, il suffit de comprendre que des alcools sont ajoutés, et que leurs chaînes latérales R (R3 et R4) se lient au carbone carbonyle. C'est pourquoi OU sont ajoutés3 et OU4 à la molécule initiale.
La principale différence entre un acétal et un cétal est la présence de l'atome d'hydrogène lié au carbone. Notez que la cétone n'a pas cet hydrogène.
Les types
Très similaire comme expliqué dans la partie nomenclature du groupe carbonyle, ses types sont fonction desquels sont les substituants A et B, ou R et R '. Par conséquent, il existe des caractéristiques structurelles qui partagent une série de composés carbonylés au-delà de l'ordre ou du type de liaisons..
Par exemple, on a mentionné au début de l'analogie entre ce groupe et le monoxyde de carbone, C = O. Si la molécule est dépourvue d'atomes d'hydrogène et s'il y a aussi deux terminaux C = O, alors ce sera un oxyde de carbone, CnOU ALORSdeux. Pour n égal à 3, on aura:
O = C = C = C = O
C'est comme s'il y avait deux molécules C≡O jointes et séparées par un carbone.
Les composés carbonylés peuvent non seulement être dérivés du gaz CO, mais aussi de l'acide carbonique, HdeuxCO3 ou OH- (C = O) -OH. Ici les deux OH représentent R et R ', et en remplaçant l'un d'entre eux ou leurs hydrogènes, on obtient des dérivés d'acide carbonique.
Et puis il y a les dérivés d'acides carboxyliques, RCOOH, obtenus en changeant les identités de R, ou en remplaçant H par un autre atome ou chaîne R '(ce qui donnerait naissance à un ester, RCOOR').
Comment l'identifier dans les aldéhydes et les cétones
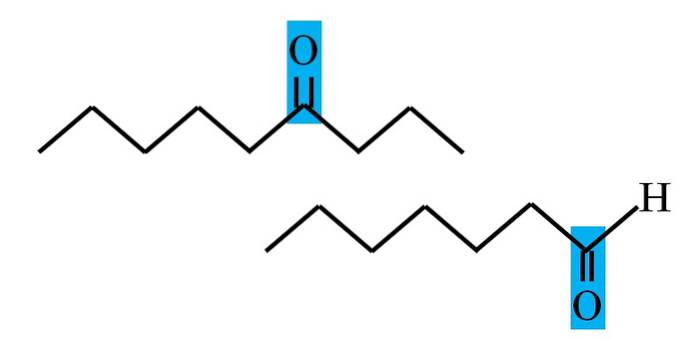
Les aldéhydes et les cétones ont en commun la présence du groupe carbonyle. Ses propriétés chimiques et physiques lui sont dues. Cependant, leurs environnements moléculaires ne sont pas les mêmes dans les deux composés; dans le premier, il est en position terminale, et dans le second, n'importe où dans la chaîne.
Par exemple, dans l'image ci-dessus, le groupe carbonyle se trouve à l'intérieur d'une boîte bleue. Dans les cétones, à côté de cette case, il doit y avoir un autre segment de carbone ou de chaîne (en haut); tandis que dans les aldéhydes, il ne peut y avoir qu'un seul atome d'hydrogène (en bas).
Si C = O est à une extrémité de la chaîne, ce sera un aldéhyde; c'est le moyen le plus direct de le différencier d'une cétone.
identifiant
Mais comment savoir expérimentalement si un composé inconnu est un aldéhyde ou une cétone? Il existe de nombreuses méthodes, depuis les tests spectroscopiques (absorption de rayonnement infrarouge, IR) ou organiques qualitatifs.
En ce qui concerne les tests qualitatifs, ceux-ci sont basés sur des réactions qui, lorsqu'elles sont positives, l'analyste observera une réponse physique; un changement de couleur, un dégagement de chaleur, la formation de bulles, etc..
Par exemple, lors de l'ajout d'une solution acide de KdeuxCrdeuxOU ALORS7 l'aldéhyde se transforme en acide carboxylique, ce qui fait passer la couleur de la solution de l'orange au vert (test positif). Pendant ce temps, les cétones ne réagissent pas, et par conséquent, l'analyste n'observe aucun changement de couleur (test négatif).
Un autre test consiste à utiliser le réactif de Tollens, [Ag (NH3)deux]+, pour l'aldéhyde pour réduire les cations Ag+ à l'argent métallique. Et le résultat: la formation d'un miroir d'argent au fond de l'éprouvette où l'échantillon a été placé..
Exemples principaux
Enfin, une série d'exemples de composés carbonylés sera listée:
-CH3COOH, acide acétique
-HCOOH, acide formique
-CH3Voiture3, propanone
-CH3VoituredeuxCH3, 2-butanone
-C6H5Voiture3, acétophénone
-CH3CHO, éthanal
-CH3CHdeuxCHdeuxCHdeuxCHO, pentanal
-C6H5CHO, benzaldéhyde
-CH3CONHdeux, acétamide
-CH3CHdeuxCHdeuxCOOCH3, acétate de propyle
Maintenant, si des exemples de composés qui possèdent simplement ce groupe sont cités, la liste deviendrait presque infinie.
Les références
- Morrison, R. T. et Boyd, R, N. (1987). Chimie organique. 5e édition. Éditorial Addison-Wesley Interamericana.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (10e édition.). Wiley plus.
- Reid Danielle. (2019). Groupe Carbonyl: Propriétés et aperçu. Étude. Récupéré de: study.com
- Sharleen Agvateesiri. (05 juin 2019). Le groupe Carbonyl. Chimie LibreTexts. Récupéré de: chem.libretexts.org
- Wiki Kids Ltd. (2018). Composés carbonylés. Récupéré de: Simply.science
- Toppr. (s.f.). Nomenclature et structure du groupe carbonyle. Récupéré de: toppr.com
- Clark J. (2015). Oxydation des aldéhydes et des cétones. Récupéré de: chemguide.co.uk



Personne n'a encore commenté ce post.