
Histoire, structure, propriétés et utilisations de l'hydrogène
le hydrogène C'est un élément chimique qui est représenté par le symbole H. Son atome est le plus petit de tous et c'est avec lui que commence le tableau périodique, peu importe où il se trouve. Il se compose d'un gaz incolore composé de molécules H diatomiquesdeux, et non par des atomes H isolés; comme cela se produit avec les gaz nobles He, Ne, Ar, entre autres.
De tous les éléments, c'est peut-être le plus emblématique et le plus remarquable, non seulement pour ses propriétés dans des conditions terrestres ou drastiques, mais pour son immense abondance et la variété de ses composés. L'hydrogène est un gaz, bien qu'inerte en l'absence de feu, inflammable et dangereux; tandis que l'eau, HdeuxOu, est le solvant universel et la vie.

À lui seul, l'hydrogène ne présente aucune particularité visuelle digne d'admiration, étant simplement un gaz stocké dans des cylindres ou des bouteilles rouges. Cependant, ce sont ses propriétés et sa capacité à se lier à tous les éléments qui rendent l'hydrogène spécial. Et tout cela, malgré le fait qu'il n'a qu'un seul électron de valence.
Si l'hydrogène n'était pas stocké dans ses cylindres respectifs, il s'échapperait dans l'espace tandis qu'une grande partie de celui-ci réagirait à l'ascension. Et bien qu'il ait une très faible concentration dans l'air que nous respirons, en dehors de la Terre et dans le reste de l'Univers, c'est l'élément le plus abondant, trouvé dans les étoiles et considéré comme son unité de construction..
Sur Terre, en revanche, il représente environ 10% de sa masse totale. Pour visualiser ce que cela signifie, il faut considérer que la surface de la planète est pratiquement recouverte d'océans et que l'hydrogène se trouve dans les minéraux, dans le pétrole brut et dans tout composé organique, en plus de faire partie de tous les êtres vivants..
Comme le carbone, toutes les biomolécules (glucides, protéines, enzymes, ADN, etc.) ont des atomes d'hydrogène. Par conséquent, il existe de nombreuses sources pour l'extraire ou le produire; cependant, peu représentent des méthodes de production vraiment rentables.
Index des articles
- 1 Histoire
- 1.1 Identification et nom
- 1.2 Electrolyse et carburant
- 1.3 Isolation
- 1.4 Deux canaux
- 2 Structure et configuration électronique
- 2.1 nombres d'oxydation
- 2.2 Phases
- 3 propriétés
- 3.1 Apparence physique
- 3.2 Point d'ébullition
- 3.3 Point de fusion
- 3.4 Point d'éclair et stabilité
- 3.5 Densité
- 3.6 Solubilité
- 3.7 Pression de vapeur
- 3.8 Température d'auto-inflammation
- 3.9 Electronégativité
- 3.10 Chaleur de combustion
- 3.11 Chaleur de vaporisation
- 3.12 Chaleur de fusion
- 3.13 Isotopes
- 3.14 Isomères des spins
- 4 Nomenclature
- 5 L'atome d'hydrogène
- 6 Où trouver et produire
- 6.1 Naturel
- 6.2 Industriel
- 6.3 Au laboratoire
- 7 réactions
- 7.1 Redox
- 7.2 Absorption
- 7.3 Ajout
- 7.4 Formation d'hydrure
- 8 utilisations
- 8.1 Matière première
- 8.2 Agent réducteur
- 8.3 Industrie pétrolière
- 8.4 Carburant
- 9 Références
Histoire
Identification et nom
Bien qu'en 1671, Robert Boyle ait été témoin pour la première fois d'un gaz qui s'est formé lorsque la limaille de fer a réagi avec des acides, c'est le scientifique britannique Henry Cavendish, en 1766, qui l'a identifié comme une nouvelle substance; "l'air inflammable".
Cavendish a découvert que lorsque cet air supposément inflammable brûlait, de l'eau était générée. Sur la base de ses travaux et de ses résultats, le chimiste français Antoine Lavoisier a donné à ce gaz le nom d'hydrogène en 1783. Étymologiquement, sa signification dérive des mots grecs «hydro» et «gènes»: former de l'eau.
Electrolyse et carburant
Peu de temps après, en 1800, les scientifiques américains William Nicholson et Sir Anthony Carlisle ont découvert que l'eau peut se décomposer en hydrogène et en oxygène; ils avaient trouvé l'électrolyse de l'eau. Plus tard, en 1838, le chimiste suisse Christian Friedrich Schoenbein a introduit l'idée de profiter de la combustion de l'hydrogène pour produire de l'électricité.
La popularité de l'hydrogène était si grande que même l'écrivain Jules Verne l'a qualifié de carburant du futur dans son livre. L'île mystérieuse (1874).
Isolation
En 1899, le chimiste écossais James Dewar fut le premier à isoler l'hydrogène sous forme de gaz liquéfié, étant lui-même celui qui put le refroidir suffisamment pour l'obtenir dans sa phase solide..
Deux canaux
À partir de ce moment, l'histoire de l'hydrogène présente deux canaux. D'une part, son développement dans le domaine des carburants et des batteries; et de l'autre, la compréhension de la structure de son atome et comment il représentait l'élément qui ouvrait les portes de la physique quantique.
Structure et configuration électronique

Les atomes d'hydrogène sont très petits et n'ont qu'un seul électron pour former des liaisons covalentes. Lorsque deux de ces atomes se rejoignent, ils donnent naissance à une molécule diatomique, Hdeux; c'est de l'hydrogène moléculaire (image du haut). Chaque sphère blanche correspond à un atome H individuel et la sphère globale aux orbitales moléculaires.
Ainsi, l'hydrogène est en fait constitué de molécules Hdeux très petits qui interagissent au moyen des forces de dispersion de Londres, car ils n'ont pas de moment dipolaire parce qu'ils sont homonucléaires. Par conséquent, ils sont très «agités» et se propagent rapidement dans l'espace car il n'y a pas de forces intermoléculaires assez fortes pour les ralentir..
La configuration électronique de l'hydrogène est simplement 1s1. Cette orbitale, 1s, est le produit de la résolution de la célèbre équation de Schrödinger pour l'atome d'hydrogène. Dans le Hdeux deux orbitales 1 se chevauchent pour former deux orbitales moléculaires: une de liaison et une anti-liaison, selon la théorie des orbitales moléculaires (TOM).
Ces orbitales permettent ou expliquent l'existence d'ions Hdeux+ ou Hdeux-; cependant, la chimie de l'hydrogène est définie dans des conditions normales par Hdeux ou ions H+ ou H-.
Numéros d'oxydation
De la configuration électronique pour l'hydrogène, 1s1, ses nombres d'oxydation possibles sont très faciles à prévoir; en gardant à l'esprit, bien sûr, que l'orbitale 2s d'énergie supérieure n'est pas disponible pour les liaisons chimiques. Ainsi, à l'état basal, l'hydrogène a un indice d'oxydation de 0, H0.
S'il perd son seul électron, l'orbitale 1s reste vide et l'ion ou cation hydrogène, H, se forme.+, très mobile dans presque tous les milieux liquides; surtout l'eau. Dans ce cas, son indice d'oxydation est +1.
Et quand le contraire se produit, c'est-à-dire gagner un électron, l'orbitale aura maintenant deux électrons et deviendra 1sdeux. Ensuite, le nombre d'oxydation devient -1, et correspond à l'anion hydrure, H-. Il est à noter que le H- il est isoélectronique à l'hélium de gaz rare, He; c'est-à-dire que les deux espèces ont le même nombre d'électrons.
En résumé, les nombres d'oxydation de l'hydrogène sont: +1, 0 et -1 et la molécule Hdeux compte comme ayant deux atomes d'hydrogène H0.
Les phases
La phase d'hydrogène préférée, au moins dans les conditions terrestres, est la phase gazeuse, pour les raisons précédemment exposées. Cependant, lorsque les températures diminuent de l'ordre de -200 ºC, ou si la pression augmente des centaines de milliers de fois celle de la pression atmosphérique, l'hydrogène peut se condenser ou cristalliser en phase liquide ou solide, respectivement..
Dans ces conditions, les molécules Hdeux ils peuvent être alignés de différentes manières pour définir des modèles structurels. Les forces de dispersion de Londres deviennent maintenant hautement directionnelles et par conséquent les géométries ou symétries adoptées par les paires H apparaissent.deux.
Par exemple, deux paires Hdeux, c'est cela égal à écrire (Hdeux)deux définir un carré symétrique ou asymétrique. Pendant ce temps, trois paires Hdeux, ou (Hdeux)3 définir un hexagone, un peu comme ceux du carbone dans les cristaux de graphite. En fait, cette phase hexagonale est la phase principale ou la plus stable de l'hydrogène solide..
Mais que se passerait-il si le solide n'était pas constitué de molécules mais d'atomes H? Ensuite, nous traiterions de l'hydrogène métallique. Ces atomes H, rappelant les sphères blanches, peuvent définir à la fois une phase liquide et un solide métallique..
Propriétés
Apparence physique
L'hydrogène est un gaz incolore, inodore et insipide. Par conséquent, s'il y a une fuite, cela représente un risque d'explosion..
Point d'ébullition
-253 ºC.
Point de fusion
-259 ºC.
Point d'éclair et stabilité
Il explose à pratiquement n'importe quelle température s'il y a une étincelle ou une source de chaleur à proximité du gaz, même la lumière du soleil peut enflammer l'hydrogène. Cependant, tant qu'il est bien stocké, c'est un gaz peu réactif..
Densité
0,082 g / L. Il est 14 fois plus léger que l'air.
Solubilité
1,62 mg / L à 21 ºC dans l'eau. Il est, en termes généraux, insoluble dans la plupart des liquides.
La pression de vapeur
1,24 106 mmHg à 25 ° C Cette valeur donne une idée de la fermeture des bouteilles d'hydrogène pour empêcher le gaz de s'échapper.
La température d'auto-inflammation
560vºC.
Électronégativité
2.20 sur l'échelle de Pauling.
Chaleur de combustion
-285,8 kJ / mol.
Chaleur de vaporisation
0,90 kJ / mol.
Température de fusion
0,117 kJ / mol.
Les isotopes
L'atome d'hydrogène «normal» est le protium, 1H, qui représente environ 99,985% de l'hydrogène. Les deux autres isotopes de cet élément sont le deutérium, deuxH et tritium, 3H. Ceux-ci diffèrent par le nombre de neutrons; le deutérium a un neutron, tandis que le tritium a deux.
Isomères de spin
Il existe deux types d'hydrogène moléculaire, Hdeux: l'ortho et le para. Dans le premier, les deux spins (du proton) des atomes H sont orientés dans la même direction (ils sont parallèles); tandis que dans le second, les deux spins sont dans des directions opposées (ils sont antiparallèles).
L'hydrogène-para est le plus stable des deux isomères; mais avec l'augmentation de la température, le rapport ortho: para devient 3: 1, ce qui signifie que l'isomère hydrogène-ortho prédomine sur l'autre. À des températures très basses (à distance proches du zéro absolu, 20 K), des échantillons d'hydrogène pur peuvent être obtenus - pour.
Nomenclature
La nomenclature pour désigner l'hydrogène est l'une des plus simples; bien qu'il n'en soit pas de même pour ses composés inorganiques ou organiques. Le Hdeux Il peut être appelé par les noms suivants en plus de `` hydrogène '':
-Hydrogène moléculaire
-Dihydrogène
-Molécule d'hydrogène diatomique.
Pour l'ion H+ leurs noms sont proton ou ion hydrogène; et s'il est en milieu aqueux, H3OU ALORS+, cation hydronium. Alors que l'ion H- est l'anion hydrure.
L'atome d'hydrogène
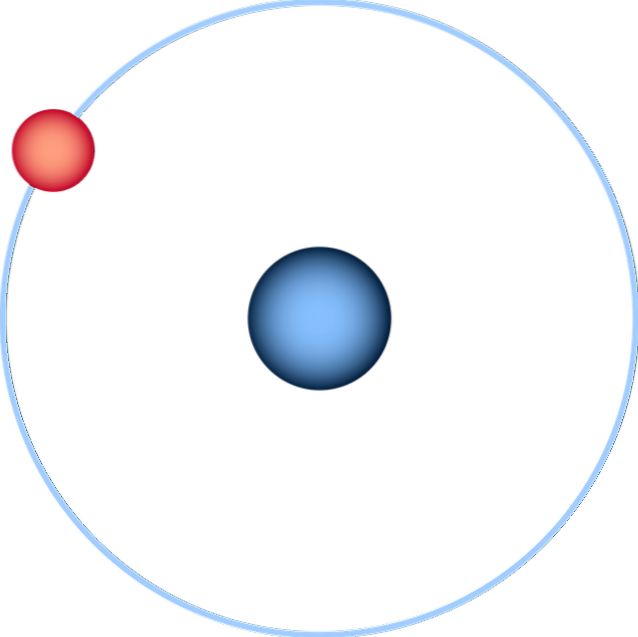
L'atome d'hydrogène est le plus simple de tous et est normalement représenté comme dans l'image ci-dessus: un noyau avec un seul proton (pour le 1H), entouré d'un électron qui dessine une orbite. Toutes les orbitales atomiques des autres éléments du tableau périodique ont été construites et estimées sur cet atome..
Une représentation plus fidèle à la compréhension actuelle des atomes serait celle d'une sphère dont la périphérie est définie par l'électron et le nuage probabiliste de l'électron (son orbitale 1).
Où il se trouve et production

L'hydrogène est, quoique peut-être à un moindre degré par rapport au carbone, l'élément chimique dont on peut dire sans doute qu'il est partout; dans l'air, faisant partie de l'eau qui remplit les mers, les océans et notre corps, dans le pétrole brut et les minéraux, ainsi que dans les composés organiques qui sont assemblés pour créer la vie.
Il suffit de parcourir n'importe quelle bibliothèque de composés pour y trouver des atomes d'hydrogène..
La question n'est pas tant de savoir combien mais comment elle est présente. Par exemple, la molécule Hdeux il est si volatil et réactif sous l'incidence des rayons solaires, qu'il est très rare dans l'atmosphère; par conséquent, il réagit pour rejoindre d'autres éléments et ainsi gagner en stabilité.
Alors que plus haut dans le cosmos, l'hydrogène se trouve principalement sous forme d'atomes neutres, H.
En fait, l'hydrogène est considéré, dans sa phase métallique et condensée, comme la pierre angulaire des étoiles. Comme il en existe des quantités incommensurables et, en raison de sa robustesse et de ses dimensions colossales, ils font de cet élément le plus abondant de tout l'univers. On estime que 75% de la matière connue correspond à des atomes d'hydrogène.
Naturel
Recueillir des atomes d'hydrogène libres dans l'espace semble peu pratique et les extraire des périphéries du Soleil, ou nébuleuses, est inaccessible. Sur Terre, où ses conditions forcent cet élément à exister en tant que Hdeux, peut être produit par des processus naturels ou géologiques.
Par exemple, l'hydrogène a son propre cycle naturel dans lequel certaines bactéries, microbes et algues peuvent le générer par des réactions photochimiques. La mise à l'échelle des processus naturels et parallèlement à ceux-ci comprend l'utilisation de bioréacteurs, où les bactéries se nourrissent d'hydrocarbures pour libérer l'hydrogène qu'ils contiennent.
Les êtres vivants sont également producteurs d'hydrogène, mais dans une moindre mesure. Si tel n'était pas le cas, il ne serait pas possible d'expliquer en quoi il constitue l'un des composants gazeux de la flatulence; qui se sont révélés excessivement inflammables.
Enfin, il faut mentionner que dans des conditions anaérobies (sans oxygène), par exemple dans les couches souterraines, les minéraux peuvent réagir lentement avec l'eau pour produire de l'hydrogène. La réaction de Fayelita le prouve:
3FedeuxOui4 + 2 heuresdeuxO → 2 Fe3OU ALORS4 + 3 SiOdeux + 3 Hdeux
Industriel
Bien que le biohydrogène soit une alternative pour générer ce gaz à l'échelle industrielle, les méthodes les plus utilisées consistent pratiquement à «éliminer» l'hydrogène des composés qui le contiennent, afin que ses atomes s'unissent et forment Hdeux.
Les méthodes de production les moins respectueuses de l'environnement consistent à faire réagir du coke (ou du charbon de bois) avec de la vapeur surchauffée:
C (s) + HdeuxO (g) → CO (g) + Hdeux(g)
De même, le gaz naturel a été utilisé à cette fin:
CH4(g) + HdeuxO (g) → CO (g) + 3Hdeux(g)
Et comme les quantités de coke ou de gaz naturel sont énormes, il est rentable de produire de l'hydrogène par l'une ou l'autre de ces deux réactions..
Une autre méthode pour obtenir de l'hydrogène consiste à appliquer une décharge électrique sur l'eau pour la décomposer en ses parties élémentaires (électrolyse):
2 heuresdeuxO (l) → 2 Hdeux(g) + Odeux(g)
Dans le laboratoire
L'hydrogène moléculaire peut être préparé en petites quantités dans n'importe quel laboratoire. Pour ce faire, un métal actif doit être mis à réagir avec un acide fort, soit dans un bécher, soit dans une éprouvette. Le bouillonnement observable est un signe clair de formation d'hydrogène, représenté par l'équation générale suivante:
M (s) + nH+(ac) → Mn+(ac) + Hdeux(g)
Où n est la valence du métal. Par exemple, le magnésium réagit avec H+ pour produire Hdeux:
Mg (s) + 2H+(ac) → Mgdeux+(ac) + Hdeux(g)
Réactions
Redox
Les nombres d'oxydation offrent à eux seuls un premier aperçu de la façon dont l'hydrogène participe aux réactions chimiques. Le Hdeux en réagissant, il peut rester inchangé ou se diviser en ions H+ ou H- en fonction de l'espèce avec laquelle il est lié; s'ils sont plus ou moins électronégatifs que lui.
Le Hdeux il n'est pas très réactif en raison de la force de sa liaison covalente, H-H; Cependant, ce n'est pas un obstacle absolu à sa réaction et à la formation de composés avec presque tous les éléments du tableau périodique..
Sa réaction la plus connue est celle de l'oxygène gazeux pour produire des vapeurs d'eau:
Hdeux(g) + Odeux(g) → 2HdeuxO (g)
Et telle est son affinité pour l'oxygène pour former la molécule d'eau stable qu'il peut même réagir avec lui comme un anion O.deux- dans certains oxydes métalliques:
Hdeux(g) + CuO (s) → Cu (s) + HdeuxO (l)
L'oxyde d'argent réagit également ou est "réduit" par la même réaction:
Hdeux(g) + AgO (s) → Ag (s) + HdeuxO (l)
Ces réactions d'hydrogène correspondent au type redox. Autrement dit, réduction-oxydation. L'hydrogène s'oxyde à la fois en présence d'oxygène et des oxydes métalliques de métaux moins réactifs que lui; par exemple, le cuivre, l'argent, le tungstène, le mercure et l'or.
Absorption
Certains métaux peuvent absorber l'hydrogène gazeux pour former des hydrures métalliques, qui sont considérés comme des alliages. Par exemple, les métaux de transition tels que le palladium absorbent des quantités importantes de Hdeux, ressemblant aux éponges métalliques.
La même chose se produit avec les alliages métalliques plus complexes. De cette manière, l'hydrogène peut être stocké par d'autres moyens que ses cylindres..
Une addition
Les molécules organiques peuvent également «absorber» l'hydrogène par le biais de différents mécanismes moléculaires et / ou interactions..
Pour les métaux, les molécules Hdeux ils sont entourés par les atomes métalliques dans leurs cristaux; tandis que dans les molécules organiques, la liaison H-H se rompt pour former d'autres liaisons covalentes. Dans un sens plus formel: l'hydrogène n'est pas absorbé, mais est ajouté à la structure.
L'exemple classique est l'ajout du Hdeux à la double ou triple liaison des alcènes ou alcynes, respectivement:
C = C + Hdeux → H-C-C-H
C≡C + Hdeux → HC = CH
Ces réactions sont également appelées hydrogénation..
Formation d'hydrure
L'hydrogène réagit directement avec les éléments pour former une famille de composés chimiques appelés hydrures. Il existe principalement de deux types: saline et moléculaire.
De même, il y a les hydrures métalliques, qui sont constitués des alliages métalliques déjà mentionnés lorsque ces métaux absorbent l'hydrogène gazeux; et les polymères, avec des réseaux ou des chaînes de maillons E-H, où E désigne l'élément chimique.
Saline
Dans les hydrures salins, l'hydrogène participe à la liaison ionique comme l'anion hydrure, H-. Pour que cela se forme, l'élément doit nécessairement être moins électronégatif; sinon il n'abandonnerait pas ses électrons à l'hydrogène.
Par conséquent, les hydrures salins ne se forment que lorsque l'hydrogène réagit avec des métaux hautement électropositifs, tels que les alcalins et les alcalino-terreux..
Par exemple, l'hydrogène réagit avec le sodium métallique pour produire de l'hydrure de sodium:
2Na (s) + Hdeux(g) → 2NaH (s)
Ou avec du baryum pour produire de l'hydrure de baryum:
Ba (s) + Hdeux(g) → BaHdeux(s)
Moléculaire
Les hydrures moléculaires sont encore mieux connus que les hydrures ioniques. Ils sont également appelés halogénures d'hydrogène, HX, lorsque l'hydrogène réagit avec un halogène:
Cldeux(g) + Hdeux(g) → 2HCl (g)
Ici l'hydrogène participe à la liaison covalente comme H+; puisque, les différences entre les électronégativités entre les deux atomes ne sont pas très grandes.
La même eau peut être considérée comme un hydrure d'oxygène (ou oxyde d'hydrogène) dont la réaction de formation a déjà été discutée. La réaction avec le soufre est très similaire pour donner du sulfure d'hydrogène, un gaz nauséabond:
S (s) + Hdeux(g) → HdeuxS (g)
Mais de tous les hydrures moléculaires, le plus connu (et peut-être le plus difficile à synthétiser) est l'ammoniac:
Ndeux(g) + 3Hdeux(g) → 2NH3(g)
Applications
Dans la section précédente, l'une des principales utilisations de l'hydrogène a déjà été abordée: comme matière première pour le développement de la synthèse, inorganique ou organique. Le contrôle de ce gaz n'a généralement pas d'autre but que de le faire réagir pour créer d'autres composés que ceux dont il a été extrait..
Matière première
- C'est l'un des réactifs pour la synthèse de l'ammoniac, qui à son tour a des applications industrielles infinies, à commencer par la production d'engrais, même en tant que matériau pour azoter les médicaments..
- Il est destiné à réagir avec le monoxyde de carbone et ainsi produire massivement du méthanol, un réactif très important dans les biocarburants..
Agent réducteur
- C'est un réducteur pour certains oxydes métalliques, il est donc utilisé en réduction métallurgique (déjà expliqué dans le cas du cuivre et d'autres métaux).
- Réduisez les graisses ou les huiles pour produire de la margarine.
Industrie pétrolière
Dans l'industrie pétrolière, l'hydrogène est utilisé pour «hydrotraiter» le pétrole brut dans les processus de raffinage..
Par exemple, il cherche à fragmenter des molécules grosses et lourdes en petites molécules avec une plus grande demande sur le marché (hydrocraquage); libérer les métaux piégés dans les cages de pétroporphyrine (hydrodémétallisation); éliminer les atomes de soufre comme HdeuxS (hydrodésulfuration); ou réduire les doubles liaisons pour créer des mélanges riches en paraffine.
Le carburant
L'hydrogène lui-même est un excellent carburant pour les fusées ou les engins spatiaux, car de petites quantités de celui-ci, lorsqu'elles réagissent avec l'oxygène, libèrent d'énormes quantités de chaleur ou d'énergie..
À plus petite échelle, cette réaction est utilisée pour la conception de cellules ou de batteries à hydrogène. Cependant, ces cellules rencontrent les difficultés de ne pas pouvoir stocker correctement ce gaz; et le défi de devenir complètement indépendant de la combustion de combustibles fossiles.
Du côté positif, l'hydrogène utilisé comme carburant ne libère que de l'eau; au lieu de gaz qui représentent des moyens de pollution pour l'atmosphère et les écosystèmes.
Les références
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Hanyu Liu, Li Zhu, Wenwen Cui et Yanming Ma. (S.f.). Structures à température ambiante d'hydrogène solide à haute pression. State Key Lab of Superhard Materials, Jilin University, Changchun 130012, Chine.
- Pierre-Marie Robitaille. (2011). Hydrogène métallique liquide: un élément constitutif du soleil liquide. Département de radiologie, Université d'État de l'Ohio, 395 W.12th Ave, Columbus, Ohio 43210, États-Unis.
- Le groupe Bodner. (s.f.). La chimie de l'hydrogène. Récupéré de: chemed.chem.purdue.edu
- Wikipédia. (2019). Hydrogène. Récupéré de: en.wikipedia.org
- Hydrogen Europe. (2017). Applications de l'hydrogène. Récupéré de: hydrogeneurope.eu
- Foist Laura. (2019). Hydrogène: propriétés et occurrence. Étude. Récupéré de: study.com
- Jonas James. (4 janvier 2009). L'histoire de l'hydrogène. Récupéré de: altenergymag.com



Personne n'a encore commenté ce post.