
Qu'est-ce que l'hydrolyse et exemples de réactions

La hydrolyse C'est une réaction chimique qui peut se produire dans des molécules ou des ions inorganiques et organiques, et qui implique la participation de l'eau pour rompre leurs liaisons. Son nom vient du grec, `` hydro '' de l'eau et `` lyse '' de rupture.
La molécule d'eau, HdeuxOu bien, il établit un équilibre avec les ions de sels d'acides et de bases faibles, ce concept apparaissant pour la première fois dans les études générales de chimie et en chimie analytique. C'est donc l'une des réactions chimiques les plus simples.
Dans plusieurs exemples d'hydrolyse, l'eau seule est incapable de rompre une certaine liaison covalente. Lorsque cela se produit, le processus est accéléré ou catalysé par acidification ou alcalinisation du milieu; c'est-à-dire en présence d'ions H3OU ALORS+ u OH-, respectivement. De même, il existe des enzymes qui catalysent l'hydrolyse.
L'hydrolyse occupe une place particulière en ce qui concerne les biomolécules, car les liaisons qui maintiennent leurs monomères ensemble sont susceptibles de s'hydrolyser dans certaines conditions. Par exemple, les sucres sont hydrolysés pour décomposer les polysaccharides en leurs monosaccharides constituants grâce à l'action des enzymes glucosidases.
Index des articles
- 1 Qu'est-ce que l'hydrolyse?
- 2 Exemples de réactions d'hydrolyse
- 2.1 - ATP
- 2.2 - Eau
- 2.3 - Protéines
- 2.4 - Amides et esters
- 2.5 - Acide-base
- 3 Références
Qu'est-ce que l'hydrolyse?
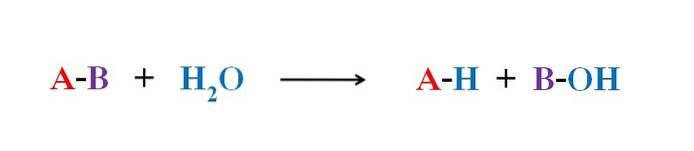
L'image ci-dessus explique en quoi consiste l'hydrolyse. Notez que non seulement la molécule ou le substrat (si les enzymes interviennent) rompt sa liaison, mais aussi l'eau elle-même, qui se «fracture» en H+ et OH-, où H+ se termine par A et OH- avec B. A-B réagit ainsi avec une molécule d'eau produisant deux produits, A-H et B-OH.
L'hydrolyse est donc la réaction opposée à la condensation. Dans la condensation, deux produits, à savoir A-H et B-OH, se rejoignent au moyen de la libération d'une petite molécule: l'eau. Dans l'hydrolyse, une molécule est consommée, tandis que dans la condensation, elle est libérée ou produite.
Revenant à l'exemple des sucres, supposons que A-B correspond à un dimère de saccharose, où A représente le glucose et B représente le fructose. La liaison A-B, glycosidique, peut être hydrolysée pour engendrer les deux monosaccharides séparément et en solution, et il en va de même pour les oligo et les polysaccharides si les enzymes interviennent dans de telles réactions.
Notez que dans cette réaction, A-B, la flèche n'a qu'une seule direction; c'est-à-dire qu'il s'agit d'une hydrolyse irréversible. Cependant, de nombreuses hydrolyse sont en fait des réactions réversibles qui atteignent un équilibre.
Exemples de réactions d'hydrolyse
- ATP
L'ATP est stable entre des valeurs de pH de 6,8 et 7,4. Cependant, à des valeurs de pH extrêmes, il s'hydrolyse spontanément. Chez les êtres vivants, l'hydrolyse est catalysée par des enzymes appelées ATPases:
ATP + HdeuxO => ADP + Pi
Cette réaction est fortement exergonique, car l'entropie de l'ADP est supérieure à celle de l'ATP. La variation de l'énergie libre de Gibbs (ΔGº) est de - 30,5 kJ / mol. L'énergie produite par l'hydrolyse de l'ATP est utilisée dans de nombreuses réactions endergoniques.
Réactions couplées
Dans certains cas, l'hydrolyse de l'ATP est utilisée pour la conversion d'un composé (A) en un composé (B).
A + ATP + HdeuxOU ALORS <=> B + ADP + Pi + H+
- L'eau
Deux molécules d'eau peuvent réagir l'une avec l'autre lors d'une hydrolyse apparente:
HdeuxO + HdeuxOU ALORS <=> H3OU ALORS+ + Oh-
C'est comme si l'une de ces molécules d'eau se fracturait en H+ et OH-, va lier le H+ à l'atome d'oxygène de l'autre molécule d'eau, qui donne naissance à l'ion hydronium, H3OU ALORS+. Cette réaction, plus que l'hydrolyse, concerne l'autoionisation ou l'autoprotolyse de l'eau.
- Protéine
Les protéines sont des macromolécules stables et pour réaliser leur hydrolyse complète, dans les acides aminés qui les constituent, des conditions extrêmes sont nécessaires; comme une concentration d'acide chlorhydrique (6 M) et des températures élevées.
Cependant, les êtres vivants sont dotés d'un arsenal enzymatique qui permet l'hydrolyse des protéines en acides aminés dans le duodénum. Les enzymes impliquées dans la digestion des protéines sont presque entièrement sécrétées par le pancréas.
Il existe des enzymes exopeptidases qui dégradent les protéines, en commençant par leurs extrémités: l'aminopeptidase à l'extrémité amino et la carboxypeptidase à l'extrémité carboxyle. Les enzymes endopeptidases exercent leur action à l'intérieur de la chaîne protéique, par exemple: trypsine, pepsine, chymotrypsine, etc..
- Amides et esters
Les amides, lorsqu'ils sont chauffés en milieu alcalin, donnent naissance à un acide carboxylique et à une amine:
RCONHdeux + HdeuxO => RCOO- + NHdeux
Les esters en milieu aqueux sont hydrolysés en un acide carboxylique et un alcool. Le processus est catalysé par une base ou un acide:
RCO-OR '+ HdeuxO => RCOOH + R'OH
C'est la fameuse réaction de saponification.
- Base acide
Dans l'eau, plusieurs espèces sont hydrolysées pour acidifier ou alcaliniser le milieu aqueux.
Ajouter un sel basique
L'acétate de sodium, un sel basique, se dissocie dans l'eau pour donner des ions Na+ (sodium) et CH3ROUCOULER- (acétate). Sa basicité est due au fait que l'acétate est hydrolysé pour générer des ions OH-, tandis que le sodium reste inchangé:
CH3ROUCOULER- + HdeuxOU ALORS <=> CH3COOH + OH-
L'OH- est responsable de l'élévation du pH et du devenir basique.
Ajout d'un sel acide
Chlorure d'ammonium (NH4Cl) est formé par l'ion chlorure (Cl-) de l'acide chlorhydrique (HCl), d'un acide fort et du cation ammonium (NH4+) à partir d'hydroxyde d'ammonium (NH4OH), une base faible. Le CL- Il ne se dissocie pas dans l'eau, mais le cation ammonium se transforme en eau comme suit:
NH4+ + HdeuxOU ALORS <=> NH3 + H3OU ALORS+
L'hydrolyse du cation ammonium produit des protons qui augmentent l'acidité d'un milieu aqueux, on en conclut donc que NH4Cl est un sel acide.
Ajouter un sel neutre
Le chlorure de sodium (NaCl) est un sel produit de la réaction d'une base forte (NaOH) avec un acide fort (HCl). En dissolvant le chlorure de sodium dans l'eau, le cation sodium (Na+) et l'anion (Cl-). Les deux ions ne se dissocient pas dans l'eau, ils n'ajoutent donc pas de H+ u OH-, garder son pH constant.
Par conséquent, le chlorure de sodium est considéré comme un sel neutre..
Les références
- Mathews, C. K., van Holde, K. E. et Ahern, K. G. (2002). Biochimie. (Troisième édition). Éditer. Pearson-Addison Wesley.
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE.
- Helmenstine, Anne Marie, Ph.D. (13 janvier 2019). Hydrolyse: définition et exemples. Récupéré de: thinkco.com
- Theresa Phillips. (28 avril 2019). Une explication du processus d'hydrolyse. Récupéré de: thebalance.com
- Les rédacteurs de l'Encyclopaedia Britannica. (2016, 16 novembre). Hydrolyse. Encyclopædia Britannica. Récupéré de: britannica.com
- Wikipédia. (2019). Hydrolyse. Récupéré de: en.wikipedia.org



Personne n'a encore commenté ce post.