
Structure des hydrocarbures cycliques, propriétés, exemples

Les hydrocarbures cycliques Ce sont des composés organiques constitués d'atomes de carbone et d'hydrogène qui se lient pour former des cycles ou des structures cycliques. Il existe principalement de trois types: alicyclique, aromatique et polycyclique.
Ces types d'hydrocarbures peuvent alors être constitués des versions fermées des alcanes, alcènes et alcynes; ont des cycles avec des systèmes aromatiques, tels que le benzène et ses dérivés; ou présenter des structures complexes et fascinantes. De tous, les alicycliques sont les plus simples et sont généralement représentés à l'aide de polygones.
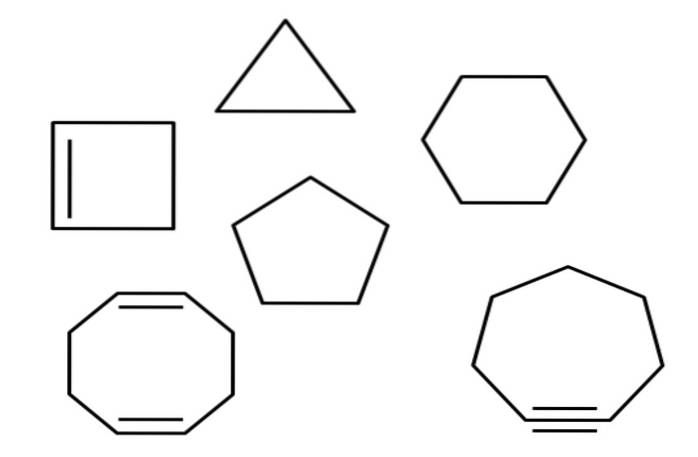
Au-dessus par exemple vous avez plusieurs hydrocarbures alicycliques. Ils ressemblent à de simples polygones: un carré, un triangle, un pentagone, un hexagone, etc. Si l'une de ses liaisons C-C pouvait être coupée avec une paire de ciseaux, le résultat serait un alcane, un alcène (s'il a des doubles liaisons) ou un alcyne (s'il a des triples liaisons).
Leurs propriétés ne diffèrent pas trop des hydrocarbures à chaîne ouverte dont ils sont issus; bien que, chimiquement, plus ils sont gros, plus ils seront stables et leur interaction avec un milieu moléculaire deviendra plus prononcée (en raison de leur plus grande surface de contact).
Index des articles
- 1 Structure
- 1.1 Conformations
- 2 propriétés
- 2.1 Forces intermoléculaires
- 3 Nomenclature
- 4 exemples
- 5 Références
Structure
Pour en venir directement à la question qui concerne leurs structures, il convient de préciser qu'elles ne sont pas plates, même lorsqu'elles le semblent dans leur représentation de polygones. La seule exception à cette affirmation se trouve dans le cyclopropane (le triangle), puisque ses trois points doivent nécessairement reposer sur le même plan..
Il est également nécessaire de préciser que les termes «cycles» et «anneaux» sont souvent interchangeables; un anneau n'a pas besoin d'être circulaire, et par conséquent il peut acquérir des géométries infinies tant qu'il s'agit d'une structure fermée. On dit alors que le cyclopropane a un anneau ou un cycle triangulaire.
Tous les carbones ont des hybridations sp3, ainsi leurs géométries sont tétraédriques et leurs liaisons doivent idéalement être séparées d'un angle de 109,5 °; cependant, cela n'est pas possible pour des structures aussi fermées que le cyclopropane, le cyclobutane (carré) ou le cyclopentane (pentagone).
On parle alors d'une tension qui déstabilise la molécule, et est déterminée expérimentalement en mesurant les chaleurs moyennes de combustion de chaque groupe CHdeux.
Les conformations
Et que se passe-t-il quand il y a des doubles ou des triples liaisons? La tension augmente, car là où il y en a une, la structure sera obligée de «rétrécir» et de rester à plat; qui, consécutivement, forcerait une conformation au-dessus des autres, éclipsant probablement les atomes d'hydrogène voisins.

Dans l'image ci-dessus, deux conformères pour le cyclohexane sont montrés pour essayer d'expliquer ce qui précède. Les atomes qui sont dans les positions à ou alors et ils sont dits respectivement axiaux ou équatoriaux. Notez qu'au lieu d'un hexagone plat, vous avez une chaise (à gauche) et un bateau (à droite).
Ces structures sont dynamiques et établissent un équilibre entre elles. Si les atomes dans à ils sont très volumineux, l'anneau va "s'accommoder" pour les positionner dans les positions équatoriales; puisqu'ils y sont orientés vers les côtés de l'anneau (ce qui renforcerait ou altérerait les interactions intermoléculaires).
Si nous regardons chaque carbone séparément, on verra qu'ils sont tétraédriques. Ce ne serait pas le cas s'il y avait une double liaison: leurs hybridations spdeux ils forceraient la structure à s'aplatir; et s'il y a une triple liaison, pour s'aligner. La structure plane du benzène est la représentation maximale de ce.
Propriétés
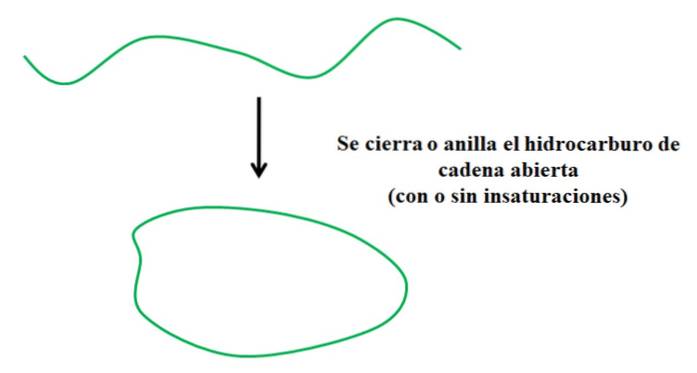
Supposons que vous ayez un hydrocarbure à chaîne ouverte (avec ou sans insaturations ou ramifications). Si nous pouvions joindre ses extrémités, cela créerait un anneau ou un cycle (comme dans l'image ci-dessus).
Du point de vue de la synthèse organique, cela ne se passe pas comme ça; il doit y avoir de bons groupes partants liés aux extrémités de la chaîne, qui en partant, favorisent la fermeture de la chaîne (si la solution est très diluée).
Dans cette optique, on constate que l'hydrocarbure trace verte ne subit qu'une transformation par rapport à sa structure; sans rompre ou ajouter de nouvelles liaisons avec d'autres atomes. Cela signifie que chimiquement, cela continue d'être le même avant et après la fermeture ou l'annelage..
Par conséquent, les propriétés chimiques ou physiques de ces hydrocarbures alicycliques ne diffèrent pas trop de leurs homologues à chaîne ouverte. Les deux sont réactifs contre les mêmes espèces (c'est-à-dire les halogènes sous la lumière ultraviolette) et peuvent subir une forte oxydation ou brûler en dégageant de la chaleur..
Forces intermoléculaires
Il y a un fait indéniable: l'anneau a une plus grande surface de contact que la chaîne ouverte, et donc ses interactions intermoléculaires sont plus fortes.
Le résultat est que leurs points d'ébullition et de fusion ont tendance à être plus élevés, tout comme leurs densités. Autant de différences peuvent être notées dans leurs indices de réfraction ou pressions de vapeur.
Nomenclature
Revenant à l'exemple de l'hydrocarbure avec un trait vert, sa nomenclature reste inchangée une fois qu'il s'est refermé sur lui-même (comme un serpent se mordant la queue). Par conséquent, les règles de dénomination restent les mêmes; sauf si les hydrocarbures polycycliques ou aromatiques sont abordés.
Trois composés sont présentés ci-dessous, qui recevront leurs noms propres:
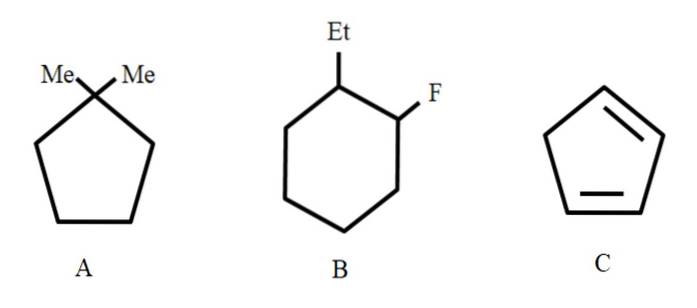
Pour commencer, comme ce sont des structures fermées, le cycle des préfixes est utilisé pour y faire référence (ici le mot anneau est relégué).
De gauche à droite, nous avons: un cyclopentane, un cyclohexane et un autre cyclopentane. Les carbones sont listés de telle manière que les substituants reçoivent les plus petits nombres, et ils sont également mentionnés par ordre alphabétique..
Ainsi, A est: 1,1-diméthylcyclopentane. En B, nous commençons par mentionner le substituant éthyle avant le fluor, donc son nom est: 1-éthyl-2-fluorocyclohexane. Et puis pour C, les doubles liaisons sont prises comme substituants, le nombre de carbones qui le forment doit être indiqué: 1,3-cyclopentadiène.
Exemples
Tout au long de l'article, on a mentionné plusieurs hydrocarbures cycliques. Dans la première image se trouvent: cyclopropane, cyclobutane, cyclopentane, cyclohexane, cycloheptane et cyclooctane.
Une large gamme de dérivés peut être obtenue à partir d'eux, et il suffit d'y placer des doubles ou triples liaisons pour avoir respectivement des cycloalcènes ou des cycloalcines. Et en ce qui concerne les hydrocarbures aromatiques, il suffit de garder à l'esprit le cycle benzénique et de le remplacer ou de le reproduire en deux dimensions..
Cependant, les plus extraordinaires (et problématiques pour comprendre leur nomenclature) sont les hydrocarbures polycycliques; c'est-à-dire que de simples polygones ne suffisent même pas pour les représenter de manière simple. Trois d'entre eux méritent d'être mentionnés: Cuban, Canastano et Pagoda (images ci-dessous).
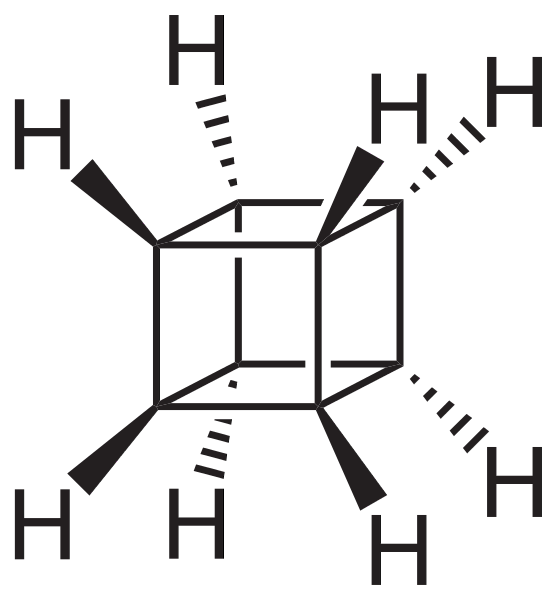
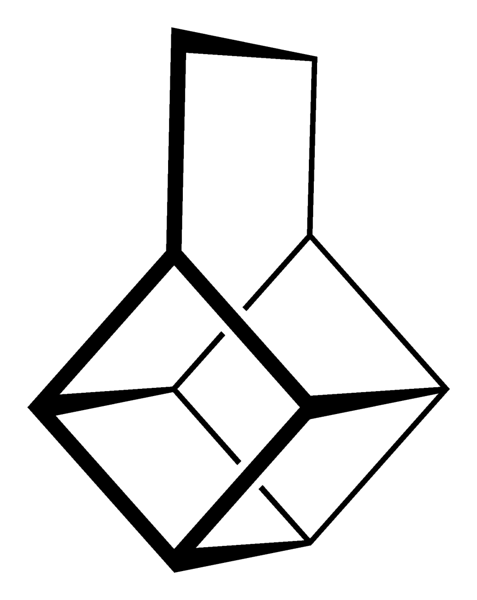

Chacun d'eux a sa méthodologie de synthèse complexe, son histoire, son art et une fascination latente pour les possibilités structurelles infinies que les hydrocarbures simples peuvent atteindre..
Les références
- Morrison, R. T. et Boyd, R, N. (1987). Chimie organique. 5e édition. Éditorial Addison-Wesley Interamericana.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (10e édition.). Wiley plus.
- Reid Danielle. (2019). Hydrocarbures cycliques: définition et exemple. Étude. Récupéré de: study.com
- Fondation CK-12. (05 juin 2019). Hydrocarbures cycliques. Chimie LibreTexts. Récupéré de: chem.libretexts.org
- Wikipédia. (2019). Composé cyclique. Récupéré de: en.wikipedia.org
- Cowboy Miguel. (2019). Hydrocarbures cycliques. Récupéré de: deciencias.net



Personne n'a encore commenté ce post.